Kto odkrył aluminium. Aluminium: właściwości chemiczne i fizyczne
Udokumentowane odkrycie glinu miało miejsce w 1825 roku. Metal ten został po raz pierwszy otrzymany przez duńskiego fizyka Hansa Christiana Oersteda, kiedy wyizolował go poprzez działanie amalgamatu potasowego na bezwodny chlorek glinu (otrzymywany przez przepuszczanie chloru przez gorącą mieszaninę tlenku glinu i węgla ). Po oddestylowaniu rtęci Oersted otrzymał aluminium, chociaż było ono zanieczyszczone zanieczyszczeniami. W 1827 roku niemiecki chemik Friedrich Wöhler otrzymał aluminium w postaci proszku poprzez redukcję heksafluoroglinianu potasem. Nowoczesną metodę produkcji aluminium odkrył w 1886 roku młody amerykański badacz Charles Martin Hall. (W latach 1855-1890 wyprodukowano zaledwie 200 ton aluminium, a w ciągu następnej dekady, stosując metodę Halla, na całym świecie wyprodukowano 28 000 ton tego metalu.) Aluminium o czystości ponad 99,99% uzyskano po raz pierwszy metodą elektrolizy w 1920 roku. W 1925 roku Edwards opublikował pewne informacje na temat właściwości fizycznych i mechanicznych takiego aluminium. W 1938 r Taylor, Willey, Smith i Edwards opublikowali artykuł, w którym podają pewne właściwości aluminium o czystości 99,996%, również otrzymywanego we Francji metodą elektrolizy. Pierwsze wydanie monografii dotyczącej właściwości aluminium ukazało się w 1967 roku. Do niedawna uważano, że aluminium, jako metal wysoce aktywny, nie może występować w przyrodzie w stanie wolnym, lecz w 1978 roku. W skałach platformy syberyjskiej odkryto rodzime aluminium - w postaci nitkowatych kryształów o długości zaledwie 0,5 mm (o grubości gwintu kilku mikrometrów). Rodzime aluminium odkryto także w księżycowej glebie sprowadzonej na Ziemię z regionów Mórz Kryzysu i Obfitości.
Aluminiowe materiały budowlane
Związki glinu są znane człowiekowi od czasów starożytnych. Jednym z nich były spoiwa, do których zaliczał się ałun glinowo-potasowy KAl(SO4)2. Znalazły szerokie zastosowanie. Stosowano je jako zaprawę i zatykacz krwi. Impregnacja drewna roztworem ałunu potasowego sprawiła, że stało się ono niepalne. Ciekawostką historyczną jest fakt, że Archelaus, wódz rzymski, podczas wojny z Persami nakazał posmarować ałunem wieże, które pełniły funkcję budowli obronnych. Persom nigdy nie udało się ich spalić.
Kolejnym związkiem glinu były glinki naturalne, do których zaliczał się tlenek glinu Al2O3.
Pierwsze próby uzyskania aluminium pojawiły się dopiero w połowie XIX wieku. Próba podjęta przez duńskiego naukowca H.K. Oersteda została uwieńczona sukcesem. Aby go uzyskać, użył amalgamatowanego potasu jako reduktora glinu z tlenku. Nie udało się jednak wówczas ustalić, jaki rodzaj metalu uzyskano. Jakiś czas później, dwa lata później, aluminium otrzymał niemiecki chemik Wöhler, który otrzymywał aluminium poprzez ogrzewanie bezwodnego chlorku glinu metalicznym potasem.
Wieloletnia praca niemieckiego naukowca nie poszła na marne. W ciągu 20 lat udało mu się przygotować granulat metalu. Okazał się podobny do srebra, ale był znacznie lżejszy. Aluminium było bardzo drogim metalem i do początku XX wieku jego cena była wyższa niż cena złota. Dlatego przez wiele, wiele lat aluminium służyło jako eksponat muzealny. Około 1807 roku Davy próbował przeprowadzić elektrolizę tlenku glinu i uzyskał metal zwany aluminium (Alumium) lub aluminium (Aluminium), co z łaciny tłumaczy się jako ałun.
Produkcja aluminium z glin była przedmiotem zainteresowania nie tylko chemików, ale także przemysłowców. Aluminium było bardzo trudne do oddzielenia od innych substancji, co przyczyniło się do tego, że było droższe od złota. W 1886 roku chemik C.M. Hall zaproponował metodę, która umożliwiła uzyskanie metalu w dużych ilościach. Prowadząc badania rozpuścił tlenek glinu w stopionym kriolicie AlF3 nNaF. Otrzymaną mieszaninę umieszczono w granitowym naczyniu i przez stop przepuszczono stały prąd elektryczny. Był bardzo zaskoczony, gdy po pewnym czasie odkrył na dnie naczynia płytki z czystego aluminium. Metoda ta jest obecnie główną metodą produkcji aluminium na skalę przemysłową. Powstały metal był dobry we wszystkim z wyjątkiem wytrzymałości, która była niezbędna dla przemysłu. I ten problem został rozwiązany. Niemiecki chemik Alfred Wilm stopił aluminium z innymi metalami: miedzią, manganem i magnezem. W rezultacie powstał stop, który był znacznie mocniejszy niż aluminium.
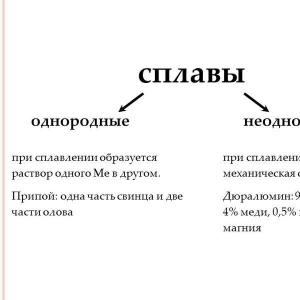
Metody uzyskiwania
| |||
W przemyśle aluminium produkowane jest poprzez elektrolizę Al2O3 w stopionym kriolicie Na3 w temperaturze 950°C
2Al2O3 = 4Al(3+) + 6O(2-) = 2Al + 3O2
Główne reakcje procesów:
CaF2 + H2SO4 → 2HF + CaSO4 (15.z)
SiO2 + 6HF →H2SiF6 + 2H2
HF i H2SiF6 to produkty gazowe wychwytywane przez wodę. Aby odsilikonować powstały roztwór, najpierw wprowadza się do niego obliczoną ilość sody:
H2SiF6 + Na2CO3 → Na2SiF6 + CO2 + H2O (15.i)
Oddziela się trudno rozpuszczalny Na2SiF6, a pozostały roztwór kwasu fluorowodorowego zobojętnia nadmiarem sody i wodorotlenku glinu, otrzymując kriolit:
12HF + 3Na2CO3 + 2Al(OH)3 → 2(3NaF AlF3) + 3CO2 + 9H2O (15.k)
NaF i AlF3 można otrzymać oddzielnie w ten sam sposób, jeśli odsilikonowany roztwór kwasu fluorowodorowego zobojętni się obliczoną ilością Na2CO3 lub Al(OH)3.
Właściwości fizyczne
Aluminium to srebrzystobiały metal, lekki i trwały. Jego gęstość wynosi 2,7 g/cm3, czyli jest prawie trzy razy lżejsza od żelaza. Jest dobrze przetworzone: walcowane, kute, tłoczone, ciągnione w drut, ma dobre przewodnictwo elektryczne (po srebrze i miedzi jest najlepszym przewodnikiem ciepła i prądu elektrycznego)
Właściwości chemiczne
1) Aluminium metaliczne tworzy stopy z wieloma metalami: Cu, In, Mg, Mn, Ni, Cr itp.
2) Aluminium oddziałuje z wieloma niemetalami: w postaci pyłu i wiórów spala się w tlenie, uwalniając dużą ilość ciepła, tworząc tlenek glinu:
4 Al + 3O2 → Al2O3
3) Aluminium oddziałuje z wieloma złożonymi substancjami. Aluminium jest praktycznie odporne na działanie wody, gdyż pokryte jest cienką warstwą tlenku. W wysokich temperaturach, pozbawiony filmu ochronnego, oddziałuje z wodą zgodnie z równaniem
2Al + 6 H2O → 2Al(OH)3 + 3H2
Aplikacja
Stopy na bazie aluminium są szeroko stosowane, ponieważ są lekkie, mocne i odporne na działanie powietrza, wody i kwasów. W elektrotechnice aluminium wykorzystuje się do produkcji masywnych drutów w liniach napowietrznych i kablach wysokiego napięcia; w produkcji kondensatorów elektrycznych, prostowników, urządzeń półprzewodnikowych; jako materiał konstrukcyjny w reaktorach jądrowych; w sprzęcie i aparaturze dla przemysłu spożywczego. Noże dostarczane są w opakowaniu po 10 sztuk (z wyjątkiem noży do amputacji), nasmarowane środkiem konserwującym lub zamknięte w plastikowej torbie z inhibitorami korozji.
Przed pakowaniem skalpele smaruje się cienką warstwą naturalnego tłuszczu i umieszcza w 10 sztukach. w pudełkach kartonowych ze szczelinami zabezpieczającymi krawędzie tnące przed stępieniem.
Cążki medyczne: przed pakowaniem każdy instrument, wstępnie pokryty neutralnym środkiem smarnym, jest owijany w pergamin lub woskowany papier i umieszczany po 5-10 sztuk w pudełkach kartonowych. Przy dłuższym przechowywaniu narzędzia należy rozładować sprężynę, w tym celu jej górny koniec (skierowany w stronę szczęk) należy odsunąć od płaszczyzny narzędzia, czyli przesunąć od gałęzi na boki i w ten sposób zapobiec zmęczeniu wiosny.
Dopuszcza się pakowanie narzędzi tego samego typu w opakowania zbiorcze bez opakowania konsumenckiego lub typu skin. Opakowania konsumenckie wraz z narzędziami należy pakować w opakowania zbiorcze – pudełka, paczki, torby, probówki i inne opakowania progresywne. Materiały użyte do produkcji pojemników oraz konstrukcja pojemnika muszą zapewniać bezpieczeństwo narzędzi podczas transportu i przechowywania. Opakowania konsumenckie i grupowe muszą uniemożliwiać ich otwarcie bez naruszenia integralności opakowania podczas transportu i przechowywania. Podczas otwierania opakowania przy użyciu pojemników wielokrotnego użytku nie należy naruszać integralności pojemnika. Powierzchnie opakowań konsumenckich i zbiorczych nie powinny posiadać zniekształceń, pęknięć, rozdarć, wypaczeń, dziur i zagięć. Na powierzchni skrzynek z materiałów polimerowych dopuszcza się ślady po łączniku formy, wlewkach i wypychaczach.
Wniosek
Wiadomo, że w elementach p podpoziom p zewnętrznego poziomu elektronicznego jest wypełniony elektronami, które mogą zawierać od jednego do sześciu elektronów.
W układzie okresowym jest 30 pierwiastków p. Te pierwiastki p lub ich analogi p-elektronów tworzą podgrupy IIIA, IVA, VA, VIA, VIIA i VI IIA. Struktura zewnętrznego poziomu elektronowego atomów pierwiastków tych podgrup rozwija się następująco: ns2 p1, ns2 p2, ns2 p3, ns2 p4, ns2 p5 i ns2 p6.
Generalnie pierwiastki p, z wyjątkiem aluminium, mają stosunkowo słabą aktywność redukcyjną. Przeciwnie, podczas przejścia z podgrupy IIIA do VIIA obserwuje się wzrost aktywności oksydacyjnej atomów obojętnych, wzrastają wartości powinowactwa elektronowego i energii jonizacji oraz wzrasta elektroujemność pierwiastków p.
W atomach pierwiastka p wartościowość mają nie tylko p-elektrony, ale także s-elektrony poziomu zewnętrznego. Najwyższy dodatni stopień utlenienia analogów p-elektronicznych jest równy numerowi grupy, w której się znajdują.
Bibliografia
1. Drozdov A.A., Chemia organiczna 2012
2. Komissarov L.N., Chemia nieorganiczna 2011
3. Nesvezhisky S.N., formuły w chemii 2012
4. Tretyakova Yu.D., Chemia nieorganiczna 2011-2012
5. http://tochmeh.ru/info/alum2.php
6. http://www.bestreferat.ru/referat-121916.html
Nazwa „aluminium” pochodzi od „aluminium”, substancji odkrytej przez angielskiego chemika Humphry’ego Davy’ego w 1807 roku. Rdzeń słowa „ałun” oznacza „ałun”, który jest solą aluminium.
Próby Humphreya wyizolowania odkrytego przez niego metalu w czystej postaci zakończyły się niepowodzeniem i dopiero w 1825 roku innemu naukowcowi, Duńczykowi Hansowi Christianowi Oerstedowi, udało się uzyskać aluminium pozbawione zanieczyszczeń.

Kolejne 20 lat później niemiecki naukowiec Friedrich Wehler przeprowadził pierwsze dogłębne badania właściwości aluminium. Celem Wehlera było odkrycie tajemnicy lekkości tego metalu.

Wielu ówczesnych naukowców próbowało rozwiązać problem izolacji tego metalu, proponowano różne metody, ale wszystkie miały swoje wady. I tak w połowie lat 50. XIX wieku Francuz Henri Saint-Clair Deville nauczył się produkować aluminium przy użyciu sodu, ale uzyskano zaledwie kilka kilogramów metalu lekkiego. W rezultacie metoda ta praktycznie nie była stosowana w produkcji przemysłowej, ale stała się powszechna wśród naukowców, co pozwoliło im przeprowadzić więcej eksperymentów w celu zbadania właściwości aluminium.

Historia produkcji aluminium metodą wytapiania rozpoczęła się pod koniec XIX wieku. Metodę tę odkryło w 1886 roku jednocześnie dwóch różnych naukowców: Amerykanin Charles Hall i Francuz Paul Héroult. Ciekawostką jest to, że nie tylko wynaleźli metodę Halla-Heroux, jak ją później nazwano, w tym samym roku, ale także pokrywały się daty ich urodzin i śmierci (1863-1914).


2 lata później Austriak Karl Weier zmodernizował metodę Halla-Heroulta, przyjmując jako materiał wyjściowy do produkcji aluminium boksyt zamiast tlenku glinu. Doprowadziło to do 80% spadku cen aluminium i jego powszechnego zastosowania w przemyśle.

Aluminium zaczęto stosować niemal wszędzie: od sfery domowej po produkcję broni. Wspominał o nim w swoich dziełach światowej sławy pisarz Juliusz Verne. Tam bohaterowie budowali rakiety i statki z aluminium.

Wynalezienie wielowarstwowej sklejki, gumy i oczywiście plastiku również przyczyniło się do rozwoju zastosowania aluminium. Wszystkie te materiały zostały aktywnie zintegrowane z aluminium w produkcji skomplikowanych urządzeń i mechanizmów. O dynamice rozwoju produkcji aluminium świadczy fakt, że w ciągu ponad stu lat, od końca XIX do XXI wieku, produkcja aluminium wzrosła 110 tysięcy razy i w 2010 roku wyniosła 40 milionów ton.

Przygotowanie ałunu potasowego
Aluminium(łac. Aluminium), – w układzie okresowym aluminium znajduje się w trzecim okresie, w głównej podgrupie trzeciej grupy. Ładunek rdzenia +13. Struktura elektronowa atomu to 1s 2 2s 2 2p 6 3s 2 3p 1. Metaliczny promień atomowy wynosi 0,143 nm, promień kowalencyjny wynosi 0,126 nm, konwencjonalny promień jonu Al 3+ wynosi 0,057 nm. Energia jonizacji Al – Al + 5,99 eV.
Najbardziej charakterystyczny stopień utlenienia atomu glinu to +3. Rzadko występują ujemne stany utlenienia. W zewnętrznej warstwie elektronowej atomu znajdują się wolne podpoziomy d. Z tego powodu jego liczba koordynacyjna w związkach może wynosić nie tylko 4 (AlCl 4-, AlH 4-, glinokrzemiany), ale także 6 (Al 2 O 3, 3+).
Odniesienie historyczne. Nazwa Aluminium pochodzi z języka łacińskiego. alumen - tak już w 500 rpne. zwany ałunem aluminiowym, który był używany jako zaprawa do barwienia tkanin i garbowania skór. Duński naukowiec H. K. Oersted w 1825 roku działając amalgamatem potasu na bezwodny AlCl 3, a następnie oddestylowując rtęć, otrzymał stosunkowo czysty glin. Pierwszą przemysłową metodę produkcji aluminium zaproponował w 1854 roku francuski chemik A.E. Sainte-Clair Deville: metoda polegała na redukcji podwójnego glinu i chlorku sodu Na 3 AlCl 6 metalicznym sodem. Aluminium, podobne kolorem do srebra, było początkowo bardzo drogie. W latach 1855–1890 wyprodukowano zaledwie 200 ton aluminium. Nowoczesną metodę wytwarzania aluminium metodą elektrolizy stopionego kriolitu i tlenku glinu opracowali w 1886 roku jednocześnie i niezależnie C. Hall w USA i P. Heroux we Francji.
Będąc w naturze
Aluminium jest najpowszechniejszym metalem w skorupie ziemskiej. Stanowi 5,5–6,6 mola. % frakcji lub 8 % wag. Jego główna masa jest skoncentrowana w glinokrzemianach. Niezwykle powszechnym produktem zniszczenia utworzonych przez nie skał jest glina, której główny skład odpowiada wzorowi Al 2 O 3. 2SiO2. 2H 2 O. Spośród innych naturalnych form glinu największe znaczenie ma boksyt Al 2 O 3. xH 2 O i minerały korund Al 2 O 3 i kriolit AlF 3 . 3NaF.
Paragon
Obecnie w przemyśle aluminium wytwarza się poprzez elektrolizę roztworu tlenku glinu Al 2 O 3 w stopionym kriolicie. Al 2 O 3 musi być w miarę czysty, ponieważ zanieczyszczenia z wytopionego aluminium są trudne do usunięcia. Temperatura topnienia Al 2 O 3 wynosi około 2050 o C, a kriolitu 1100 o C. Stopiona mieszanina kriolitu i Al 2 O 3 zawierająca około 10% wag. Al 2 O 3 poddawana jest elektrolizie, która topi się w temperaturze 960°C. o C i ma najkorzystniejszą dla procesu przewodność elektryczną, gęstość i lepkość. Po dodaniu AlF 3, CaF 2 i MgF 2 elektroliza staje się możliwa w temperaturze 950 o C.
Elektrolizer do wytapiania aluminium to żelazna obudowa wyłożona od wewnątrz cegłami ogniotrwałymi. Jej dno (pod spodem), złożone z bloków sprężonego węgla, pełni funkcję katody. Anody znajdują się na górze: są to aluminiowe ramy wypełnione brykietami węglowymi.
Al 2 O 3 = Al 3+ + AlO 3 3-
Na katodzie wydziela się ciekły aluminium:
Al 3+ + 3е - = Al
Aluminium zbiera się na dnie pieca, skąd jest okresowo uwalniane. Na anodzie wydziela się tlen:
4AlO 3 3- – 12e - = 2Al 2 O 3 + 3O 2
Tlen utlenia grafit do tlenków węgla. Podczas spalania węgla powstaje anoda.
Aluminium jest również stosowane jako dodatek stopowy do wielu stopów w celu nadania im odporności na ciepło.
Właściwości fizyczne aluminium. Aluminium łączy w sobie bardzo cenny zestaw właściwości: niską gęstość, wysoką przewodność cieplną i elektryczną, wysoką ciągliwość i dobrą odporność na korozję. Można go łatwo poddawać kuciu, stemplowaniu, walcowaniu, ciągnieniu. Aluminium jest dobrze spawane za pomocą spawania gazowego, kontaktowego i innych rodzajów spawania. Krata aluminiowa jest sześcienna wyśrodkowana na ścianie z parametrem a = 4,0413 Å. Właściwości aluminium, podobnie jak wszystkich metali, zależą zatem od jego czystości. Właściwości aluminium o wysokiej czystości (99,996%): gęstość (w 20°C) 2698,9 kg/m 3 ; t pl 660,24 °C; temperatura wrzenia około 2500 °C; współczynnik rozszerzalności cieplnej (od 20° do 100°C) 23,86·10 -6; przewodność cieplna (przy 190 °C) 343 W/m·K, ciepło właściwe (przy 100 °С) 931,98 J/kg·K. ; przewodność elektryczna w stosunku do miedzi (przy 20 °C) 65,5%. Aluminium charakteryzuje się niską wytrzymałością (wytrzymałość na rozciąganie 50–60 Mn/m2), twardością (170 Mn/m2 według Brinella) i dużą ciągliwością (do 50%). Podczas walcowania na zimno wytrzymałość aluminium na rozciąganie wzrasta do 115 Mn/m2, twardość do 270 Mn/m2, wydłużenie względne spada do 5% (1 Mn/m2 ~ i 0,1 kgf/mm2). Aluminium jest wysoko polerowane, anodowane i ma wysoki współczynnik odbicia zbliżony do srebra (odbija do 90% padającej energii świetlnej). Mając duże powinowactwo do tlenu, aluminium w powietrzu pokrywa się cienką, ale bardzo mocną warstwą tlenku Al 2 O 3, która chroni metal przed dalszym utlenianiem i decyduje o jego wysokich właściwościach antykorozyjnych. Wytrzymałość warstwy tlenkowej i jej działanie ochronne znacznie zmniejszają się w obecności zanieczyszczeń rtęcią, sodem, magnezem, miedzią itp. Aluminium jest odporne na korozję atmosferyczną, wodę morską i słodką, praktycznie nie wchodzi w interakcje ze stężonym lub silnie rozcieńczonym azotem kwasy, kwasy organiczne, produkty spożywcze.
Właściwości chemiczne
Po podgrzaniu drobno pokruszonego aluminium pali się energicznie na powietrzu. Podobnie przebiega jego oddziaływanie z siarką. Połączenie z chlorem i bromem następuje w zwykłych temperaturach, a z jodem - po podgrzaniu. W bardzo wysokich temperaturach aluminium łączy się również bezpośrednio z azotem i węglem. Wręcz przeciwnie, nie wchodzi w interakcję z wodorem.
Aluminium jest dość odporne na wodę. Jeśli jednak działanie ochronne warstwy tlenkowej zostanie usunięte mechanicznie lub przez amalgamację, następuje energiczna reakcja:
Wysoko rozcieńczone i bardzo stężone HNO3 i H2SO4 nie mają prawie żadnego wpływu na aluminium (na zimno), natomiast przy średnich stężeniach tych kwasów stopniowo się rozpuszczają. Czyste aluminium jest dość odporne na kwas solny, ale rozpuszcza się w nim zwykły metal przemysłowy.
Gdy aluminium zostanie wystawione na działanie wodnych roztworów zasad, warstwa tlenku rozpuszcza się i powstają gliniany - sole zawierające glin jako część anionu:
Al2O3 + 2NaOH + 3H2O = 2Na
Pozbawione filmu ochronnego aluminium oddziałuje z wodą wypierając z niej wodór:
2Al + 6H 2O = 2Al(OH) 3 + 3H 2
Powstały wodorotlenek glinu reaguje z nadmiarem zasad, tworząc hydroksyglinian:
Al(OH)3 + NaOH = Na
Ogólne równanie rozpuszczania glinu w wodnym roztworze alkalicznym:
2Al + 2NaOH + 6H 2O = 2Na + 3H 2
Aluminium rozpuszcza się zauważalnie w roztworach soli, które w wyniku hydrolizy mają odczyn kwaśny lub zasadowy, na przykład w roztworze Na2CO3.
W szeregu naprężeń znajduje się pomiędzy Mg i Zn. We wszystkich swoich stabilnych związkach glin jest trójwartościowy.
Połączenie aluminium z tlenem wiąże się z ogromnym wydzielaniem ciepła (1676 kJ/mol Al 2 O 3), znacznie większym niż w przypadku wielu innych metali. W związku z tym podczas ogrzewania mieszaniny tlenku odpowiedniego metalu z proszkiem aluminium następuje gwałtowna reakcja, która prowadzi do uwolnienia wolnego metalu z pobranego tlenku. Często stosuje się metodę redukcji z wykorzystaniem Al (aluminotermia), aby otrzymać szereg pierwiastków (Cr, Mn, V, W itp.) w stanie wolnym.
Aluminotermię czasami wykorzystuje się do spawania pojedynczych elementów stalowych, w szczególności połączeń szyn tramwajowych. Stosowana mieszanina („termit”) składa się zazwyczaj z drobnych proszków aluminium i Fe 3 O 4 . Zapala się go za pomocą zapalnika wykonanego z mieszaniny Al i BaO 2. Główna reakcja przebiega według równania:
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe + 3350 kJ
Co więcej, temperatura kształtuje się w okolicach 3000 o C.
Tlenek glinu jest białym, bardzo ogniotrwałym (t.t. 2050 o C) i nierozpuszczalnym w masie wody. Naturalny Al 2 O 3 (korund mineralny), jak również ten otrzymywany sztucznie, a następnie silnie kalcynowany, wyróżnia się dużą twardością i nierozpuszczalnością w kwasach. Al 2 O 3 (tzw. tlenek glinu) można przekształcić w stan rozpuszczalny poprzez stopienie z zasadami.
Zazwyczaj korund naturalny zanieczyszczony tlenkiem żelaza, ze względu na jego ekstremalną twardość, używany jest do produkcji ściernic, osełek itp. W postaci drobno pokruszonej nazywa się go szmerglem i służy do czyszczenia powierzchni metalowych i wytwarzania papieru ściernego. Do tych samych celów często stosuje się Al 2 O 3, otrzymywany przez stapianie boksytu (nazwa techniczna - alundum).
Przezroczyste kolorowe kryształy korundu - czerwony rubin - domieszka chromu - i niebieski szafir - domieszka tytanu i żelaza - kamienie szlachetne. Pozyskuje się je również sztucznie i wykorzystuje do celów technicznych, np. do produkcji części instrumentów precyzyjnych, kamieni do zegarków itp. Kryształy rubinu zawierające niewielką domieszkę Cr 2 O 3 wykorzystywane są jako generatory kwantowe – lasery tworzące ukierunkowaną wiązkę promieniowania monochromatycznego.
Ze względu na nierozpuszczalność Al 2 O 3 w wodzie, odpowiadający temu tlenkowi wodorotlenek Al(OH) 3 można otrzymać jedynie pośrednio z soli. Wytwarzanie wodorotlenku można przedstawić na następującym schemacie. Pod wpływem zasad jony OH – w kompleksach wodnych są stopniowo zastępowane przez 3+ cząsteczki wody:
3+ + OH - = 2+ + H 2 O
2+ + OH - = + + H 2 O
OH - = 0 + H 2 O
Al(OH) 3 to obszerny, galaretowaty, biały osad, praktycznie nierozpuszczalny w wodzie, ale łatwo rozpuszczalny w kwasach i mocnych zasadach. Ma zatem charakter amfoteryczny. Jednak jego podstawowe, a zwłaszcza kwasowe właściwości są raczej słabo wyrażone. Wodorotlenek glinu jest nierozpuszczalny w nadmiarze NH4OH. Jedna z postaci odwodnionego wodorotlenku, żel aluminiowy, stosowana jest w technologii jako adsorbent.
Podczas interakcji z mocnymi zasadami powstają odpowiednie gliniany:
NaOH + Al(OH) 3 = Na
Gliniany najbardziej aktywnych metali jednowartościowych są dobrze rozpuszczalne w wodzie, jednak ze względu na silną hydrolizę ich roztwory są stabilne tylko w obecności wystarczającego nadmiaru zasady. Gliniany produkowane na bazie słabszych zasad są prawie całkowicie hydrolizowane w roztworze i dlatego można je otrzymać jedynie na sucho (poprzez stopienie Al 2 O 3 z tlenkami odpowiednich metali). Powstają metagliniany, których skład wywodzi się z kwasu metaglinowego HAlO 2. Większość z nich jest nierozpuszczalna w wodzie.
Al(OH) 3 tworzy sole z kwasami. Pochodne większości mocnych kwasów są dobrze rozpuszczalne w wodzie, ale ulegają dość znacznej hydrolizie, dlatego ich roztwory wykazują odczyn kwasowy. Rozpuszczalne sole glinu i słabe kwasy ulegają jeszcze większej hydrolizie. Z powodu hydrolizy z roztworów wodnych nie można otrzymać siarczków, węglanów, cyjanków i niektórych innych soli glinu.
W środowisku wodnym anion Al 3+ jest bezpośrednio otoczony przez sześć cząsteczek wody. Taki uwodniony jon jest nieco zdysocjowany według schematu:
3+ + H. 2O = 2+ + OH 3 +
Jego stała dysocjacji wynosi 1. 10 -5, tj. jest słabym kwasem (mocą zbliżoną do kwasu octowego). Oktaedryczne środowisko Al 3+ z sześcioma cząsteczkami wody jest również zachowane w krystalicznych hydratach szeregu soli glinu.
Glinokrzemiany można uznać za krzemiany, w których część czworościanów krzemowo-tlenowych SiO 4 4 - zostaje zastąpiona czworościanami glinowo-tlenowymi AlO 4 5. Spośród glinokrzemianów najpowszechniejsze są skalenie, które stanowią ponad połowę masy skorupa Ziemska. Ich głównymi przedstawicielami są minerały
ortoklaz K 2 Al 2 Si 6 O 16 lub K 2 O . Al2O3. 6SiO2
albit Na 2 Al 2 Si 6 O 16 lub Na 2 O. Al2O3. 6SiO2
anortyt CaAl 2 Si 2 O 8 lub CaO. Al2O3. 2SiO2
Minerały z grupy mików są bardzo powszechne, na przykład muskowit Kal 2 (AlSi 3 O 10) (OH) 2. Duże znaczenie praktyczne ma minerał nefelina (Na, K) 2, który wykorzystuje się do produkcji tlenku glinu, wyrobów sodowych i cementu. Produkcja ta obejmuje następujące operacje: a) nefelin i wapień spiekane są w piecach rurowych w temperaturze 1200 o C:
(Na, K) 2 + 2CaCO 3 = 2CaSiO 3 + NaAlO 2 + KAlO 2 + 2CO 2
b) powstałą masę ługuje się wodą - powstaje roztwór glinianów sodu i potasu oraz zawiesina CaSiO 3:
NaAlO 2 + KAlO 2 + 4H 2 O = Na + K
c) CO2 powstający podczas spiekania przepuszcza się przez roztwór glinianu:
Na + K + 2CO 2 = NaHCO 3 + KHCO 3 + 2Al(OH) 3
d) przez ogrzewanie Al(OH) 3 otrzymuje się tlenek glinu:
2Al(OH) 3 = Al 2 O 3 + 3H 2 O
e) poprzez odparowanie ługu macierzystego oddziela się sodę i polewkę, a uzyskany wcześniej osad wykorzystuje się do produkcji cementu.
Przy produkcji 1 tony Al 2 O 3 otrzymuje się 1 tonę produktów sodowych i 7,5 tony cementu.
Niektóre glinokrzemiany mają luźną strukturę i są zdolne do wymiany jonowej. Tego typu krzemiany – naturalne i szczególnie sztuczne – wykorzystywane są do zmiękczania wody. Dodatkowo ze względu na mocno rozwiniętą powierzchnię znajdują zastosowanie jako nośniki katalizatorów tj. jako materiały impregnowane katalizatorem.
Halogenki glinu w normalnych warunkach są bezbarwnymi substancjami krystalicznymi. W serii halogenków glinu AlF 3 bardzo różni się właściwościami od swoich analogów. Jest ogniotrwały, słabo rozpuszczalny w wodzie i nieaktywny chemicznie. Główna metoda wytwarzania AlF 3 opiera się na działaniu bezwodnego HF na Al 2 O 3 lub Al:
Al 2O 3 + 6HF = 2AlF 3 + 3H 2 O
Związki glinu z chlorem, bromem i jodem są topliwe, bardzo reaktywne i dobrze rozpuszczalne nie tylko w wodzie, ale także w wielu rozpuszczalnikach organicznych. Oddziaływaniu halogenków glinu z wodą towarzyszy znaczne wydzielanie ciepła. W roztworze wodnym wszystkie ulegają silnej hydrolizie, ale w przeciwieństwie do typowych kwaśnych halogenków niemetali ich hydroliza jest niepełna i odwracalna. Będąc zauważalnie lotnymi nawet w normalnych warunkach, AlCl 3, AlBr 3 i AlI 3 dymią w wilgotnym powietrzu (w wyniku hydrolizy). Można je otrzymać poprzez bezpośrednie oddziaływanie prostych substancji.
Gęstości par AlCl 3, AlBr 3 i AlI 3 w stosunkowo niskich temperaturach mniej więcej dokładnie odpowiadają podwójnym wzorom - Al 2 Hal 6. Struktura przestrzenna tych cząsteczek odpowiada dwóm czworościanom o wspólnej krawędzi. Każdy atom glinu jest związany z czterema atomami halogenu, a każdy z centralnych atomów halogenu jest związany z obydwoma atomami glinu. Z dwóch wiązań centralnego atomu halogenu jedno jest donorem-akceptorem, przy czym aluminium pełni rolę akceptora.
Z solami halogenkowymi wielu metali jednowartościowych halogenki glinu tworzą złożone związki, głównie typu M3 i M (gdzie Hal oznacza chlor, brom lub jod). W rozważanych halogenkach tendencja do reakcji addycji jest na ogół bardzo wyraźna. Właśnie z tego powodu najważniejsze jest techniczne zastosowanie AlCl3 jako katalizatora (w rafinacji ropy naftowej i syntezach organicznych).
Spośród fluoroglinianów największym zastosowaniem (do produkcji Al, F2, emalii, szkła itp.) jest kriolit Na3. Przemysłowa produkcja sztucznego kriolitu opiera się na obróbce wodorotlenku glinu kwasem fluorowodorowym i sodą:
2Al(OH) 3 + 12HF + 3Na 2CO 3 = 2Na 3 + 3CO 2 + 9H 2 O
Chloro-, bromo- i jodogliniany otrzymuje się przez stopienie trihalogenków glinu z halogenkami odpowiednich metali.
Chociaż aluminium nie reaguje chemicznie z wodorem, wodorek glinu można otrzymać pośrednio. Jest to biała, amorficzna masa o składzie (AlH 3) n. Rozkłada się po ogrzaniu powyżej 105 o C z wydzieleniem wodoru.
Kiedy AlH3 oddziałuje z zasadowymi wodorkami w roztworze eterowym, powstają wodorogliniany:
LiH + AlH3 = Li
Wodorogliniany są białymi ciałami stałymi. Szybko rozkłada się pod wpływem wody. Są silnymi środkami redukującymi. Wykorzystuje się je (zwłaszcza Li) w syntezie organicznej.
Siarczan glinu Al 2 (SO 4) 3. 18H2O otrzymuje się przez działanie gorącego kwasu siarkowego na tlenek glinu lub kaolin. Służy do oczyszczania wody, a także do przygotowania niektórych rodzajów papieru.
Ałun potasowo-glinowy KAl(SO 4) 2. 12H 2 O stosowany jest w dużych ilościach do garbowania skór, a także w przemyśle farbiarskim jako zaprawa do tkanin bawełnianych. W tym drugim przypadku działanie ałunu polega na tym, że powstały w wyniku jego hydrolizy wodorotlenek glinu osadza się we włóknach tkaniny w stanie drobno rozproszonym i adsorbując barwnik, mocno utrzymuje go na włóknie.
Z pozostałych pochodnych glinu należy wymienić jego octan (inaczej sól kwasu octowego) Al(CH 3 COO) 3, stosowany do barwienia tkanin (jako zaprawa) oraz w medycynie (płyny i kompresy). Azotan glinu jest łatwo rozpuszczalny w wodzie. Fosforan glinu jest nierozpuszczalny w wodzie i kwasie octowym, ale rozpuszczalny w mocnych kwasach i zasadach.
Aluminium w korpusie. Aluminium wchodzi w skład tkanek zwierząt i roślin; w organach ssaków stwierdzono od 10 -3 do 10 -5% glinu (w przeliczeniu na surowiec). Aluminium gromadzi się w wątrobie, trzustce i tarczycy. W produktach roślinnych zawartość glinu waha się od 4 mg na 1 kg suchej masy (ziemniaki) do 46 mg (rzepa żółta), w produktach pochodzenia zwierzęcego od 4 mg (miód) do 72 mg na 1 kg suchej masy ( wołowina). W codziennej diecie człowieka zawartość glinu sięga 35–40 mg. Do organizmów skupiających aluminium zalicza się mchy (Lycopodiaceae), które w popiele zawierają do 5,3% glinu, oraz mięczaki (Helix i Lithorina), które w popiele zawierają 0,2–0,8% glinu. Tworząc nierozpuszczalne związki z fosforanami, glin zaburza odżywianie roślin (wchłanianie fosforanów przez korzenie) i zwierząt (wchłanianie fosforanów w jelitach).
Geochemia aluminium. O cechach geochemicznych aluminium decyduje jego duże powinowactwo do tlenu (w minerałach aluminium wchodzi w skład oktaedrów i czworościanów tlenowych), stała wartościowość (3) oraz niska rozpuszczalność większości naturalnych związków. W procesach endogenicznych podczas krzepnięcia magmy i powstawania skał magmowych aluminium przedostaje się do sieci krystalicznej skaleni, mików i innych minerałów - glinokrzemianów. W biosferze aluminium jest słabym migrantem, występuje rzadko w organizmach i hydrosferze. W wilgotnym klimacie, gdzie rozkładające się pozostałości bujnej roślinności tworzą wiele kwasów organicznych, glin migruje do gleb i wód w postaci organiczno-mineralnych związków koloidalnych; aluminium jest adsorbowane przez koloidy i odkładane w dolnych partiach gleby. Wiązanie aluminium z krzemem zostaje częściowo zerwane i w niektórych miejscach w tropikach tworzą się minerały - wodorotlenki glinu - bemit, diaspory, hydrargillit. Większość aluminium wchodzi w skład glinokrzemianów – kaolinitu, beidellitu i innych minerałów ilastych. Słaba mobilność determinuje resztkową akumulację aluminium w wietrzejącej skorupie wilgotnych tropików. W rezultacie powstaje boksyt eluwialny. W poprzednich epokach geologicznych boksyt gromadził się także w jeziorach i strefach przybrzeżnych mórz w regionach tropikalnych (na przykład boksyty osadowe Kazachstanu). Na stepach i pustyniach, gdzie jest mało materii żywej, a wody są neutralne i zasadowe, aluminium prawie nie migruje. Migracja aluminium jest najbardziej energetyczna na obszarach wulkanicznych, gdzie obserwuje się silnie kwaśne wody rzeczne i gruntowe bogate w glin. W miejscach, gdzie wody kwaśne mieszają się z alkalicznymi wodami morskimi (przy ujściach rzek i nie tylko), aluminium wytrąca się, tworząc złoża boksytów.
Zastosowanie aluminium. Połączenie właściwości fizycznych, mechanicznych i chemicznych aluminium decyduje o jego powszechnym zastosowaniu w niemal wszystkich obszarach techniki, zwłaszcza w postaci jego stopów z innymi metalami. W elektrotechnice aluminium z powodzeniem zastępuje miedź, szczególnie przy produkcji masywnych przewodów, np. w liniach napowietrznych, kablach wysokiego napięcia, szynach rozdzielczych, transformatorach (przewodność elektryczna aluminium osiąga 65,5% przewodności elektrycznej miedzi, a jest ponad trzykrotnie lżejsza od miedzi, przy przekroju zapewniającym tę samą przewodność, masa drutów aluminiowych jest o połowę mniejsza od miedzi). Ultraczyste aluminium wykorzystywane jest do produkcji kondensatorów elektrycznych i prostowników, których działanie opiera się na zdolności warstwy tlenku glinu do przepuszczania prądu elektrycznego tylko w jednym kierunku. Ultraczyste aluminium oczyszczone metodą topienia strefowego wykorzystywane jest do syntezy związków półprzewodnikowych typu A III B V, wykorzystywanych do produkcji urządzeń półprzewodnikowych. Czyste aluminium wykorzystywane jest do produkcji różnego rodzaju odbłyśników lustrzanych. Aluminium o wysokiej czystości służy do ochrony powierzchni metalowych przed korozją atmosferyczną (okładziny, farba aluminiowa). Aluminium, posiadające stosunkowo niski przekrój poprzeczny absorpcji neutronów, jest stosowane jako materiał konstrukcyjny w reaktorach jądrowych.
Zbiorniki aluminiowe o dużej pojemności przechowują i transportują gazy płynne (metan, tlen, wodór itp.), kwasy azotowy i octowy, czystą wodę, nadtlenek wodoru i oleje jadalne. Aluminium znajduje szerokie zastosowanie w urządzeniach i aparaturze przemysłu spożywczego, do pakowania żywności (w postaci folii) oraz do produkcji różnego rodzaju artykułów gospodarstwa domowego. Gwałtownie wzrosło zużycie aluminium do wykańczania budynków, obiektów architektonicznych, transportowych i sportowych.
W metalurgii aluminium (obok stopów na nim opartych) jest jednym z najpowszechniejszych dodatków stopowych do stopów na bazie Cu, Mg, Ti, Ni, Zn i Fe. Aluminium wykorzystuje się także do odtleniania stali przed wlaniem jej do formy, a także w procesach wytwarzania niektórych metali metodą aluminotermiczną. Na bazie aluminium powstał SAP (spiekany proszek aluminiowy) przy użyciu metalurgii proszków, który charakteryzuje się wysoką odpornością cieplną w temperaturach powyżej 300°C.
Aluminium wykorzystywane jest do produkcji materiałów wybuchowych (amonial, alumotol). Szeroko stosowane są różne związki aluminium.
Produkcja i zużycie aluminium stale rośnie, znacznie przewyższając tempo wzrostu produkcji stali, miedzi, ołowiu i cynku.
Wykaz używanej literatury
1. V.A. Rabinowicz, Z.Ya. Khavin „Krótki podręcznik chemiczny”
2. L.S. Guzey „Wykłady z chemii ogólnej”
3. N.S. Achmetow „Chemia ogólna i nieorganiczna”
4. B.V. Niekrasow „Podręcznik chemii ogólnej”
5. N.L. Glinka „Chemia Ogólna”
Krótka historia aluminium i jego współczesnych zastosowań
W 1825 roku duński naukowiec Hans Christian Oersted po raz pierwszy uzyskał aluminium, przepuszczając chlor przez gorącą mieszaninę tlenku glinu i węgla.
Proces polegał na późniejszym ogrzewaniu powstałego bezwodnego chlorku glinu z amalgamatem potasowym. Amalgamat następnie rozłożono przez ogrzewanie, rtęć odparowała i w ten sposób otrzymano aluminium.
W 1827 roku Friedrich Wöhler opracował metodę wytwarzania czystszego aluminium. Zastąpił aluminium z tego samego chlorku metalicznym potasem. Wöhler jako pierwszy szczegółowo opisał właściwości aluminium i zmierzył jego gęstość.
W 1855 roku francuski chemik Henri Etienne Sainte-Clair Deville opracował pierwszą przemysłową metodę produkcji aluminium, polegającą na wypieraniu aluminium przez metaliczny sód z podwójnego chlorku sodu i aluminium.
Tą metodą od 30 lat produkowane jest aluminium w fabrykach na całym świecie.
Ale aluminium mogłoby zyskać znaczenie techniczne tylko wtedy, gdyby obniżono temperaturę topnienia tlenku glinu. Rozwiązanie znaleźli Charles Martin Hall i Paul Héroult. Odkryli, że tlenek glinu dobrze rozpuszcza się w stopionym preolicie. Roztwór ten poddaje się elektrolizie w temperaturze około 950°C.
W 1887 roku niemiecki chemik Karl-Joseph Bauer otrzymał patent na izolację aluminium z rudy boksytu.
Dzięki swojej gęstości aluminium umożliwiło budowę samolotów i sterowców. Łopaty wirników helikopterów produkowane są na całym świecie ze stopu Al-Mg-Si.
Aluminium znajduje szerokie zastosowanie w produkcji samochodów, rowerów, samolotów, statków, wagonów kolejowych, bidonów, puszek...
Aluminium jest dziś metalem szczególnie cenionym i stosowanym w architekturze. Konstrukcje aluminiowe znajdują zastosowanie przy projektowaniu i budowie zarówno budynków przemysłowych, jak i mieszkalnych.
Do budowy Pałacu Pionierów w Moskwie i Piramidy w Luwrze w Paryżu wykorzystano aluminium.
W pomieszczeniach zamkniętych aluminium służy do produkcji schodów, sufitów, balustrad i mebli. Z aluminium wykonuje się także ozdoby, druty i srebrne farby. Metal ten jest bardzo ceniony jako materiał na konstrukcje szkieletowe przy oszkleniu okien, werand i witryn sklepowych.
Tlenek glinu stosowany jest do produkcji materiałów ogniotrwałych oraz do produkcji ceramiki.
Aluminium pozwala tworzyć projekty architektoniczne i wznosić budynki w rekordowym czasie, realizując przy tym najśmielsze pomysły, dając początek niezwykle oryginalnym formom.
Przygotowane przez Anastasię CHUDINOVA
| wypożyczalnia sprzętu: |