Metode de protecție împotriva coroziunii metalelor. Metode de protecție împotriva coroziunii Pentru protecție împotriva coroziunii, utilizați
Coroziune - un proces spontan și, în consecință, continuând cu o scădere a energiei Gibbs a sistemului. Energia chimică a reacției de distrugere a coroziunii metalelor este eliberată sub formă de căldură și este disipată în spațiul înconjurător.
Coroziunea duce la pierderi mari ca urmare a distrugerii conductelor, rezervoarelor, părților metalice ale mașinilor, corpurilor navelor, structurilor offshore etc. Pierderile ireversibile de metale datorate coroziunii reprezintă 15% din producția lor anuală. Scopul combaterii coroziunii este conservarea resurselor de metale, ale căror resurse mondiale sunt limitate. Studiul coroziunii și dezvoltarea metodelor de protejare a metalelor de acesta sunt de interes teoretic și au o mare importanță economică națională.
Ruginirea fierului în aer, formarea scării la temperaturi ridicate și dizolvarea metalelor în acizi sunt exemple tipice de coroziune. Ca urmare a coroziunii, multe proprietăți ale metalelor se deteriorează: rezistența și plasticitatea scad, fricțiunea dintre părțile mobile ale mașinilor crește și dimensiunile pieselor sunt încălcate. Distingeți între coroziune chimică și electrochimică.
Chimice, coroziune - distrugerea metalelor prin oxidare în gaze uscate, în soluții non-electrolitice. De exemplu, formarea scării pe fier la temperaturi ridicate. În acest caz, filmele de oxid formate pe metal previn adesea oxidarea suplimentară, prevenind pătrunderea în continuare a gazelor și lichidelor pe suprafața metalică.
Coroziune electrochimică se numește distrugerea metalelor sub acțiunea vaporilor galvanici rezultați în prezența apei sau a altor electroliți. În acest caz, împreună cu procesul chimic - eliberarea electronilor de către metale, există și un proces electric - transferul electronilor dintr-o zonă în alta.
Acest tip de coroziune este împărțit în tipuri separate: atmosferic, sol, coroziune sub influența curentului „rătăcitor” etc.
Coroziunea electrochimică este cauzată de impuritățile conținute în metal sau de eterogenitatea suprafeței sale. În aceste cazuri, când metalul intră în contact cu electrolitul, care poate fi umezeală adsorbită în aer, la suprafața sa apar multe celule microgalvanice. ... Anodi sunt particule de metal, catodii - impurități și zone ale metalului cu un potențial de electrod mai pozitiv. Anodul se dizolvă și hidrogenul este eliberat la catod. În același timp, procesul de reducere a oxigenului dizolvat în electrolit este posibil la catod. În consecință, natura procesului catodic va depinde de anumite condiții:
mediu acid: 2H + + 2ē \u003d H 2 (depolarizare cu hidrogen),
О 2 + 4Н + + 4ē → 2Н 2 О
mediu neutru: O 2 + 2H 2 O + 4e - \u003d 4OH - (depolarizarea oxigenului).
De exemplu, ia în considerare coroziune atmosferică fier în contact cu staniu. Interacțiunea metalelor cu o picătură de apă care conține oxigen duce la formarea unei celule microgalvanice, a cărei schemă are forma
(-) Fe | Fe 2+ || O2, H20 | | Sn (+).
Metalul mai activ (Fe) este oxidat, donând electroni atomilor de cupru și intră în soluție sub formă de ioni (Fe 2+). Depolarizarea oxigenului are loc la catod.
Metode de protecție împotriva coroziunii. Toate metodele de protecție împotriva coroziunii pot fi împărțite în două grupe mari: non-electrochimice(alierea metalelor, acoperiri de protecție, schimbarea proprietăților unui mediu coroziv, proiectarea rațională a produselor) și electrochimic (metoda proiectului, protecție catodică, protecție anodică).
Alierea metalelor - Aceasta este o metodă eficientă, deși costisitoare, de creștere a rezistenței la coroziune a metalelor, în care componentele care provoacă pasivarea metalelor sunt introduse în compoziția aliajului. Crom, nichel, titan, tungsten etc. sunt utilizate ca astfel de componente.
Acoperiri de protecție - acestea sunt straturi create artificial pe suprafața produselor și structurilor metalice. Alegerea tipului de acoperire depinde de condițiile în care este utilizat metalul.
Materiale pentru metal acoperirile de protecție pot fi metale pure: zinc, cadmiu, aluminiu, nichel, cupru, staniu, crom, argint și aliajele acestora: bronz, alamă etc. În funcție de comportamentul acoperirilor metalice în timpul coroziunii, acestea pot fi împărțite în catod (de exemplu, pe oțel Cu, Ni, Ag) și anod (zinc pe oțel). Acoperirile catodice pot proteja metalul de coroziune numai în absența porilor și deteriorarea acoperirii. În cazul unei acoperiri anodice, metalul care trebuie protejat acționează ca un catod și, prin urmare, nu se corodează. Dar potențialele metalelor depind de compoziția soluțiilor, prin urmare, cu o modificare a compoziției soluției, natura acoperirii se poate schimba, de asemenea. Deci, acoperirea oțelului cu staniu într-o soluție de H 2 SO 4 este catodică, iar într-o soluție de acizi organici - anodică.
Protecție nemetalică acoperirile pot fi atât anorganice, cât și organice. Efectul protector al acestor acoperiri se reduce în principal la izolarea metalului de mediul înconjurător.
Metoda de protecție electrochimică bazat pe inhibarea reacțiilor anodice sau catodice ale procesului de coroziune. Protecția electrochimică se realizează prin conectarea unui metal cu o valoare mai negativă a potențialului electrodului la structura protejată (corpul navei, conducta subterană), care se află într-un mediu electrolitic (mare, apă din sol) - călca.
Coroziunea are un efect devastator asupra produselor și aliajelor metalice. Atunci când interacționează cu mediul, produsele metalice se colorează sub formă de rugină. Cu cât metalul este mai reactiv, cu atât se corodează mai mult.
Coroziunea are un efect devastator asupra mașinilor, navelor, comunicațiilor și altor produse metalice, ceea ce poate duce la scurgeri de petrol, gaze și alte consecințe negative. Afectează negativ sănătatea umană, iar produsele de oxidare poluează mediul.
Coroziunea este inacceptabilă în industria aeriană, chimică și nucleară. Uneori, costul reparării produselor metalice depășește costul materialului folosit pentru fabricarea acestora.
Principalele tipuri de procese de coroziune
Tipurile de coroziune a metalelor pot fi împărțite în conformitate cu următoarele criterii: natura distrugerii, mediul coroziv și mecanismul de acțiune.

Pe baza naturii distrugerii, coroziunea poate fi:
- solid. Cu toate acestea, poate fi uniformă și neuniformă. Când este uniformă, întreaga suprafață a produsului este distrusă. Când sunt inegale, apar pete și depresiuni punctate;
- intercristalin. În acest caz, pătrunde adânc în produs de-a lungul granițelor boabelor metalice;
- transcristalin, în timp ce metalul este divizat printr-o fisură prin bob;
- selectiv. Una dintre componentele aliajului este distrusă. De exemplu, zincul se poate degrada în alamă.
- subteran. Începe la suprafață și pătrunde treptat în straturile superioare ale metalului.
Există următoarele tipuri de medii corozive:
- atmosfera;
- pamantul;
- lichid (soluții alcaline, acide sau saline).
Mecanismul de acțiune împarte coroziunea în chimică și electrochimică.
Coroziunea chimică este un proces în care are loc distrugerea spontană a metalelor. Apare atunci când produsele metalice interacționează cu un mediu activ coroziv, cel mai adesea unul gazos. Aceste procese sunt însoțite de temperaturi ridicate.

Ca urmare, metalul este oxidat simultan și mediul coroziv este redus. Coroziunea chimică apare și atunci când interacționează cu lichide organice, de exemplu, cu produse petroliere, alcool etc.

Coroziunea electrochimică apare în electroliți, cum ar fi soluțiile apoase. O reacție electrochimică produce un curent electric care descompune metalul. În acest caz, au loc atât procese chimice, în care are loc eliberarea de electroni, cât și electrice, în care se mișcă electronii.
Distrugerea are loc atunci când metalele diferite apar în contact. Prin urmare, metalele sunt mai susceptibile la distrugere, în care există multe impurități.
Eterogenitatea structurii metalice duce la faptul că în timpul coroziunii electrochimice, perechile catod-anod se formează în conformitate cu legile galvanizării. Dacă produsele metalice diferă între ele prin compoziția chimică, atunci se formează un strat de rugină pe suprafața produselor metalice.
Această coroziune este cel mai adesea cauza distrugerii metalelor. Mai jos sunt imaginile care arată mecanismul de acțiune al coroziunii electrochimice.

În mediul extern, oxigenul, umiditatea ridicată, oxizii de sulf, azot, dioxid de carbon și apele subterane acționează cel mai activ asupra produselor metalice. Apa sărată accelerează procesul de oxidare, motiv pentru care vasele marine ruginesc mai repede decât navele fluviale.

Este imposibil să opriți acest proces natural; nu mai rămâne decât să găsiți modalități de protecție împotriva coroziunii. Este adevărat, este imposibil să scapi complet de procesul de coroziune, dar aceste metode ajută la încetinirea procesului în sine.
Metode de rezistență la procesele corozive
Următoarele metode există pentru a proteja metalele de coroziune:
- creșterea rezistenței metalelor prin creșterea compoziției chimice;
- izolarea acoperirilor metalice de influențele agresive ale mediului;
- reducerea agresivității mediului în care sunt utilizate produsele metalice;
- electrochimice, care, datorită legilor galvanizării, reduc procesele de coroziune.
Aceste metode pot fi împărțite în două grupuri mari. Primele două metode sunt aplicate înainte ca produsele metalice să fie utilizate, adică la etapa de producție a acestora. În același timp, anumite materiale structurale sunt selectate pentru producerea produsului, se aplică diferite acoperiri galvanice și de protecție.

Ultimele două metode sunt utilizate în operarea produselor metalice. În același timp, pentru protecție, un curent este trecut prin produs, agresivitatea mediului este redusă prin adăugarea diferiților inhibitori, astfel, produsul în sine nu este pre-procesat înainte de utilizare.
Metode pentru creșterea rezistenței
Aceste metode de protecție se bazează pe crearea aliajelor care au proprietăți anticorozive. Componentele sunt adăugate metalului pentru a crește rezistența la coroziune. Un exemplu este alierea oțelului cu crom.
Metoda este utilizată la fabricarea oțelului. Rezultatul este oțeluri inoxidabile cu crom care sunt rezistente la coroziune. Ele cresc caracteristicile anticorozive ale oțelurilor prin adăugarea de nichel, cupru și cobalt.
Rugina nu apare pe aceste suprafețe, dar există coroziune. Coroziunea încetinește datorită adăugării unui atom de dopant la opt atomi de fier, iar acest lucru reglează dispunerea atomilor în rețeaua cristalină a soluției solide, care previne coroziunea.

Rezistența la coroziune poate fi îmbunătățită prin îndepărtarea impurităților din metale sau aliaje care accelerează coroziunea. De exemplu, fierul este îndepărtat din aliajele de magneziu sau aluminiu, sulful din aliajele de fier etc.
Reducerea agresivității mediului extern și protecția electrochimică
O scădere a agresivității mediului extern se realizează prin îndepărtarea substanțelor din acesta care sunt depolarizatori sau prin izolarea metalelor dintr-un depolarizator. Eliminarea oxigenului dintr-un mediu se numește dezoxidare.

Pentru a încetini procesul de coroziune, substanțe speciale sunt introduse în mediu - inhibitori. Ele pot fi atât organice, cât și anorganice. Moleculele inhibitoare sunt absorbite de suprafața metalică și, prin urmare, contribuie la o scădere bruscă a ratei de dizolvare a metalului și împiedică desfășurarea proceselor de electrod.
Cu protecție electrochimică, folosind un curent electric extern care trece prin metal, potențialul metalului este deplasat și, prin urmare, rata coroziunii acestuia se schimbă.
În funcție de schimbarea potențialului, protecția electrochimică poate fi catodică și anodică. Aceste metode sunt folosite pentru a proteja platformele de foraj, fundațiile metalice sudate, conductele care circulă subteran și, de asemenea, protejează părțile subacvatice ale navelor marine.
Protecția filmului
Pentru a proteja produsele metalice de coroziune, se poate aplica un strat protector. Ca acoperire, puteți folosi lacuri, vopsele, emailuri, materiale plastice etc.

Vopselele și lacurile sunt ușor de aplicat, costuri ieftine, au proprietăți hidrofuge, nu intră într-o reacție chimică cu metalul și umple bine porii și fisurile. Acestea servesc la protejarea metalelor de componentele de mediu care cauzează procese corozive.
Dacă alegeți vopselele și lacurile potrivite și urmați tehnologia de aplicare a acestora, atunci acestea pot servi drept acoperire până la 5 ani.
Adesea se aplică un grund sub vopsea, trecând prin care apa dizolvă niște pigmenți și devine mai puțin corozivă. În loc de grund, suprafața poate fi fosfatată. Se aplică cu pensula sau spray. Pentru produsele din oțel, majoritatea acestor preparate constau în amestecuri de mangan și fosfați de fier.

Puteți proteja un produs metalic prin aplicarea unui strat de metal care este mai rezistent la coroziune. În acest caz, coroziunea distruge acoperirea în sine. Aceste metale sunt crom, nichel, zinc. De exemplu, fierul este placat cu crom.
Descriere
Coroziunea metalului reprezintă distrugerea acestuia ca urmare a oxidării prin procese chimice sau electrochimice. Rugina este un prim exemplu de astfel de coroziune. Cu toate acestea, există multe tipuri de coroziune a metalelor.
Tipuri de coroziune a metalelor
Există mai multe clasificări ale coroziunii metalelor. Deci, în funcție de tipul de distrugere, se disting coroziunea continuă, locală și de coroziune. Primul afectează întreaga suprafață metalică în mod egal. Coroziunea localizată are ca rezultat pete de coroziune separate. Și coroziunea prin picurare indică stadiul inițial al deteriorării și se manifestă în puncte separate de distrugere.
Prin natura pătrunderii în metal, se pot distinge coroziunea intergranulară (intercristalină) și transcristalină. Primul pătrunde între boabele metalului, alegând cele mai slabe puncte ale îmbinărilor lor. Al doilea merge direct prin boabele de metal. Ambele sunt periculoase, deoarece duc rapid la crăparea metalelor și la pierderea rezistenței. În acest caz, suprafața produsului poate rămâne intactă.
În mod separat, în această clasificare, putem distinge coroziunea cuțitului, care de obicei duce la o fisură netedă situată paralel cu sudura. De regulă, apare atunci când se utilizează produse metalice în medii agresive.
Conform metodei de interacțiune a metalului cu mediul, este obișnuit să se facă distincția coroziune chimică și electrochimică. metal... Când sunt chimice, atomii metalului se leagă de atomii oxidanților care acționează asupra acestuia, care fac parte din mediu. De regulă, acest lucru se întâmplă atunci când interacționați cu un mediu care nu este un conductor de electricitate. În timpul coroziunii electrochimice, cationii din rețeaua cristalină a metalului se leagă de alte componente ale mediului coroziv. În acest caz, oxidantul însuși va obține electronii eliberați. Acest tip de coroziune este tipic pentru interacțiunea metalelor cu soluții sau electroliți topiți.
Se poate distinge tipuri de coroziune a metalelor după tipul de mediu care acționează asupra acestuia. Deci, gazul, coroziunea atmosferică, lichidă și subterană se disting. Cu toate acestea, cel mai adesea vorbim despre tipuri mixte de coroziune, atunci când mai multe medii acționează asupra metalului simultan.
Metode pentru protejarea metalelor de coroziune
Există mai multe metode de bază pentru protejarea metalului de coroziune:
- creșterea compoziției chimice a metalului în vederea îmbunătățirii caracteristicilor sale anticorozive;
- izolarea suprafeței metalice cu materiale anticorozive;
- reducerea agresivității mediului în care sunt produse și utilizate produsele metalice;
- impunerea unui curent extern care asigură protecție electrochimică împotriva coroziunii.
Astfel, este posibil să se protejeze produsele metalice de coroziune înainte sau în timpul utilizării.
Ne confruntăm cu problema de mult timp protecția metalului împotriva coroziunii și putem oferi cele mai bune opțiuni. Cea mai simplă dintre ele și utilizată pe scară largă de noi este utilizarea de acoperiri speciale de protecție metalică. Deci, utilizarea acoperirilor anodice crește la un potențial electrochimic negativ maxim al metalului, excluzând posibilitatea coroziunii. Acoperirea cu catod are un efect mai puțin pronunțat și necesită un strat mai gros, dar în același timp crește semnificativ duritatea și rezistența la uzură a produsului.
Dacă luăm în considerare tipurile de acoperire din punctul de vedere al producției lor, atunci putem distinge depunerea chimică și electrolitică, depunerea la cald și la rece, pulverizarea metalelor, placarea și tratamentul prin difuzie termică.
Una dintre cele mai populare modalități de a proteja metalul de coroziune este aplicarea compușilor nemetalici. Poate fi plastic, ceramică, cauciuc, bitum, poliuretan, vopsele și lacuri și multe altele. Mai mult, acestea din urmă reprezintă cea mai largă gamă și pot fi utilizate în funcție de condițiile de mediu în care va fi utilizat produsul. Astfel se disting straturile de vopsea și lac rezistente la efectele apei, atmosferei, soluțiilor chimice etc.
Pentru a atenua acțiunea unui mediu coroziv, o cantitate mică de inhibitori poate fi introdusă în acesta, ceea ce duce la neutralizarea sau dezoxigenarea mediului și formează o peliculă de adsorbție care protejează suprafața metalică. În acest caz, filmul poate modifica într-o oarecare măsură parametrii electrochimici ai metalelor.
Protecția electrochimică împotriva coroziunii metalelor constă în polarizare catodică sau anodică (acțiunea externă a curentului). De asemenea, este posibil să se facă acest lucru prin atașarea de protecții de inhibare a coroziunii la produsul metalic.
În producția modernă, o mare importanță este acordată dezvoltării aliajelor metalice rezistente la coroziune. De exemplu, rezistența la coroziune este mult îmbunătățită atunci când cromul și nichelul sunt adăugate la un aliaj de fier. Aliajele de magneziu în același scop sunt aliate cu mangan, iar aliajele de nichel cu cupru.
Compania noastră „Chermetkom” acordă o atenție deosebită problemei protejării produselor metalice împotriva coroziunii, aplicării acoperirilor speciale, prelucrării produselor metalice cu curent electric sau efectuării protecției de protecție. De asemenea, puteți achiziționa produse de la noi din aliaje rezistente la coroziune. Mai mult, metalul și produsele din acesta pot fi cumpărate la depozitele noastre din Moscova sau comandate să fie fabricate conform unui proiect individual.
În plus
O filă suplimentară pentru postarea informațiilor despre magazin, livrare sau orice alt conținut important. Vă va ajuta să răspundeți la întrebările cumpărătorului și să eliminați îndoielile sale cu privire la achiziție. Folosește-l după cum consideri potrivit.
Puteți să-l eliminați sau să îl returnați schimbând o casetă de selectare din setările componentei. Foarte confortabil.
Coroziunea este distrugerea metalului, ceramicii, lemnului și a altor materiale ca urmare a interacțiunii chimice sau fizico-chimice. În ceea ce privește motivele apariției unui astfel de efect nedorit, acestea sunt diferite. În majoritatea cazurilor, aceasta este o instabilitate structurală la efectele termodinamice ale mediului. Să aruncăm o privire mai atentă la ceea ce este coroziunea. Trebuie luate în considerare și tipurile de coroziune și nu va fi inutil să vorbim despre protecția împotriva acesteia.
Câteva informații generale
Suntem obișnuiți să auzim termenul „ruginire”, care este folosit în cazul coroziunii metalelor și aliajelor. Există, de asemenea, un astfel de concept ca „îmbătrânire” - este caracteristic polimerilor. În esență, sunt același lucru. Un exemplu frapant este îmbătrânirea produselor din cauciuc datorită interacțiunii active cu oxigenul. În plus, unele elemente din plastic sunt distruse sub influență.Rata de coroziune este direct dependentă de condițiile în care se află obiectul. Deci, rugina pe un produs metalic se va răspândi cu atât mai repede cu cât temperatura este mai mare. Umiditatea afectează, de asemenea: cu cât este mai mare, cu atât devine mai rapidă pentru o utilizare ulterioară. S-a stabilit experimental că aproximativ 10 la sută din produsele metalice sunt anulate irevocabil, iar coroziunea este de vină. Tipurile de coroziune sunt diferite și sunt clasificate în funcție de tipul de mediu, de natura fluxului și altele asemenea. Să le aruncăm o privire mai atentă.
Clasificare
În prezent, există mai mult de două duzini de opțiuni de ruginire. Vom prezenta doar cele mai de bază tipuri de coroziune. Ele pot fi împărțite condiționat în următoarele grupuri:
- Coroziunea chimică este un proces de interacțiune cu un mediu coroziv, în care reducerea oxidantului are loc într-un singur act. Metalul și oxidantul nu sunt separați spațial.
- Coroziunea electrochimică - procesul de interacțiune a unui metal cu ionizarea atomilor și reducerea oxidantului au loc în diferite acte, dar rata depinde în mare măsură de potențialul electrodului.
- Coroziunea gazelor - ruginirea chimică a metalului la un conținut minim de umiditate (nu mai mult de 0,1%) și / sau la temperaturi ridicate într-un mediu gazos. Cel mai adesea, această specie se găsește în industria de rafinare chimică și petrolieră.

În plus, există mult mai multe procese de ruginire. Toate sunt coroziune. Tipurile de coroziune, pe lângă cele descrise mai sus, includ biologice, radioactive, atmosferice, de contact, locale, rugină țintă etc.
Coroziunea electrochimică și caracteristicile sale
Cu acest tip de distrugere, procesul are loc atunci când metalul intră în contact cu electrolitul. Acesta din urmă poate fi apă condensată sau apă de ploaie. Cu cât sunt mai multe săruri și acizi în lichid, cu atât conductivitatea electrică este mai mare și, în consecință, viteza procesului. În ceea ce privește locurile structurii metalice cele mai susceptibile la coroziune, acestea sunt nituri, îmbinări sudate, locuri de deteriorare mecanică. Dacă proprietățile structurale ale aliajului de fier îl fac rezistent la ruginire, procesul încetinește oarecum, dar continuă oricum. Galvanizarea este un prim exemplu. Faptul este că zincul are un potențial mai negativ decât fierul. Din acest motiv simplu, aliajul de fier este redus și zincul se corodează. Cu toate acestea, prezența unui film de oxid la suprafață încetinește foarte mult procesul de distrugere. Desigur, toate tipurile de coroziune electrochimică sunt extrem de periculoase și uneori chiar imposibile de luptat cu ele.

Coroziune chimică
Această schimbare a metalului este destul de frecventă. Un exemplu izbitor este apariția scării ca urmare a interacțiunii produselor metalice cu oxigenul. Temperatura ridicată, în acest caz, acționează ca un accelerator al procesului și lichide precum apa, sărurile, acizii, alcalii și soluțiile de sare pot participa la acesta. Dacă vorbim despre materiale precum cuprul sau zincul, atunci oxidarea lor duce la formarea unui film rezistent la coroziune suplimentară. Produsele din oțel formează oxizi de fier. Conduce în continuare la apariția ruginii, care nu oferă nicio protecție împotriva distrugerii ulterioare, ci, dimpotrivă, contribuie la aceasta. În prezent, toate tipurile de coroziune chimică sunt eliminate prin zincare. Se pot aplica și alte mijloace de protecție.

Tipuri de coroziune a betonului
Modificările structurii și creșterea fragilității betonului sub influența mediului pot fi de trei tipuri:
- Distrugerea părților din piatra de ciment este unul dintre cele mai frecvente tipuri de coroziune. Apare atunci când un produs din beton este expus sistematic la precipitații și alte lichide. Ca urmare, hidratul de oxid de calciu este spălat și structura este perturbată.
- Interacțiunea cu acizii. Dacă piatra de ciment intră în contact cu acizii, atunci se formează bicarbonat de calciu - un element chimic agresiv pentru un produs din beton.
- Cristalizarea substanțelor greu solubile. În esență, aceasta este biocorozia. Concluzia este că microorganismele (spori, ciuperci) intră în pori și se dezvoltă acolo, în urma cărora are loc distrugerea.

Coroziune: tipuri, metode de protecție
Pierderile anuale de miliarde de dolari i-au determinat pe oameni să se lupte cu aceste efecte nocive. Este sigur să spunem că toate tipurile de coroziune duc la pierderea nu a metalului în sine, ci a structurilor metalice valoroase, pentru construcția cărora se cheltuiesc mulți bani. Este dificil de spus dacă este posibil să se asigure o protecție 100%. Cu toate acestea, cu o pregătire adecvată a suprafeței, care implică sablare abrazivă, se pot obține rezultate bune. Stratul de vopsea și lac protejează fiabil împotriva coroziunii electrochimice dacă este aplicat corect. Și tratamentul special al suprafeței va proteja în mod fiabil împotriva distrugerii metalelor sub sol.
Metode active și pasive de luptă
Esența metodelor active este schimbarea structurii câmpului electric dublu. Pentru aceasta, se utilizează o sursă de curent constantă. Tensiunea trebuie selectată astfel încât să crească produsul de protejat. O altă metodă extrem de populară este anodul sacrificial. Se prăbușește, protejând materialul de bază.

Protecția pasivă implică utilizarea vopselei. Sarcina principală este de a preveni complet umezeala, precum și oxigenul, de a pătrunde pe suprafața protejată. După cum sa menționat puțin mai sus, este logic să folosiți pulverizarea de zinc, cupru sau nichel. Chiar și un strat parțial distrus va proteja metalul de rugină. Desigur, aceste tipuri de protecție împotriva coroziunii metalelor sunt eficiente numai atunci când suprafața nu prezintă defecte vizibile sub formă de fisuri, așchii și altele asemenea.
Galvanizarea în detaliu
Am examinat deja principalele tipuri de coroziune, dar acum aș dori să vorbesc despre cele mai bune metode de protecție. Una dintre acestea este zincarea. Esența sa constă în faptul că zincul sau aliajul său se aplică pe suprafața de tratat, ceea ce conferă suprafeței anumite proprietăți fizice și chimice. Trebuie remarcat faptul că această metodă este considerată una dintre cele mai economice și eficiente și asta în ciuda faptului că aproximativ 40% din producția mondială a acestui element este cheltuită pentru metalizarea zincului. Galvanizarea poate fi aplicată pe foi de oțel, elemente de fixare, dispozitive și alte structuri metalice. Interesant este că placarea sau pulverizarea metalelor pot proteja orice dimensiune și formă. Zincul nu are scop decorativ, deși cu ajutorul unor aditivi speciali devine posibil să se obțină suprafețe strălucitoare. În principiu, acest metal este capabil să ofere o protecție maximă în medii agresive.
Concluzie

Așa că v-am spus despre ce este coroziunea. De asemenea, au fost luate în considerare tipurile de coroziune. Acum știi cum să protejezi suprafața de ruginirea prematură. În general, este extrem de simplu să faceți acest lucru, dar unde și cum este utilizat produsul nu are o importanță mică. Dacă este supus în mod constant la sarcini dinamice și de vibrații, atunci există o mare probabilitate de crăpături în vopsele și acoperiri de lac, prin care umezeala va pătrunde în metal, ca urmare a căruia se va prăbuși treptat. Cu toate acestea, utilizarea diferitelor garnituri și etanșări din cauciuc în zonele de interacțiune metalică poate prelungi ușor durata de viață a acoperirii.
Ei bine, asta e tot subiectul. Amintiți-vă că defectarea structurală prematură din cauza coroziunii poate avea consecințe neintenționate. La întreprindere, sunt posibile daune materiale importante și pierderi de vieți omenești ca urmare a ruginirii structurii metalice de susținere.
Principala condiție pentru protecția anticorozivă a metalelor și aliajelor este scăderea ratei de coroziune. Este posibil să se reducă rata de coroziune utilizând diferite metode de protejare a structurilor metalice de coroziune. Principalele sunt:
1 Acoperiri de protecție.
2 Tratarea unui mediu coroziv pentru a reduce corozivitatea (în special cu volume constante de medii corozive).
3 Protecție electrochimică.
4 Dezvoltarea și producția de noi materiale structurale cu rezistență sporită la coroziune.
5 Tranziția într-o serie de structuri de la metal la materiale rezistente chimic (materiale plastice moleculare ridicate, sticlă, ceramică etc.).
6 Proiectarea și funcționarea rațională a structurilor și pieselor metalice.
1. Acoperiri de protecție
Învelișul de protecție trebuie să fie continuu, distribuit uniform pe întreaga suprafață, impermeabil mediului, să aibă o aderență ridicată (rezistență la aderență) la metal, să fie dur și rezistent la uzură. Coeficientul de dilatare termică ar trebui să fie apropiat de coeficientul de dilatare termică a metalului obiectului protejat.
Clasificarea acoperirilor de protecție este prezentată în Fig. 43
Acoperiri de protecție
Acoperiri metalice nemetalice
InorganicOrganicCathodeAnode
Figura 43 - Schema de clasificare a acoperirilor de protecție
1.1 Acoperiri metalice
Aplicarea acoperirilor metalice de protecție este una dintre cele mai comune metode de combatere a coroziunii. Aceste acoperiri nu numai că protejează împotriva coroziunii, dar oferă și suprafeței lor o serie de proprietăți fizice și mecanice valoroase: duritate, rezistență la uzură, conductivitate electrică, lipire, reflectivitate, asigură finisaje decorative produselor etc.
Conform metodei de acțiune de protecție, acoperirile metalice sunt împărțite în cele catodice și anodice.
Acoperirile cu catod au un potențial de electrod mai pozitiv și mai anodic - mai electronegativ comparativ cu potențialul metalului pe care sunt aplicate. Deci, de exemplu, cuprul, nichelul, argintul, aurul, depuse pe oțel, sunt acoperiri cu catod, iar zincul și cadmiul în raport cu același oțel sunt acoperiri anodice.
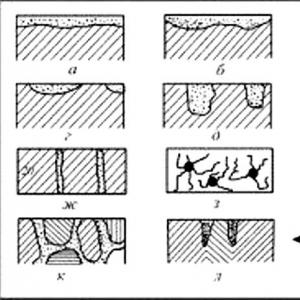
Trebuie remarcat faptul că tipul de acoperire depinde nu numai de natura metalelor, ci și de compoziția mediului coroziv. Stanțul în raport cu fierul în soluții de acizi anorganici și săruri joacă rolul unui strat catodic, iar într-un număr de acizi organici (conserve) servește ca anod. În condiții normale, acoperirile cu catod protejează mecanic produsul metalic, izolându-l de mediu. Principala cerință pentru acoperirile cu catod este porozitatea. În caz contrar, atunci când produsul este scufundat într-un electrolit sau când o peliculă subțire de umezeală se condensează pe suprafața sa, zonele expuse (în pori sau fisuri) ale metalului de bază devin anodi, iar suprafața de acoperire devine un catod. În locurile de discontinuitate, va începe coroziunea metalului de bază, care se poate răspândi sub acoperire (Fig. 44 a).
Figura 11 Schema de coroziune a fierului cu un catod poros (a) și acoperire anodică (b)
Acoperirile anodice protejează metalul produsului nu numai mecanic, ci în principal electrochimic. În celula galvanică rezultată, metalul de acoperire devine anod și suferă coroziune, iar zonele expuse (în pori) ale metalului de bază acționează ca catoduri și nu sunt distruse atâta timp cât contactul electric al acoperirii cu metalul protejat este menținut și curent suficient trece prin sistem (Fig. 4 b). Prin urmare, gradul de porozitate al acoperirilor anodice, spre deosebire de acoperirile cu catod, nu joacă un rol semnificativ.
În unele cazuri, protecția electrochimică poate avea loc atunci când se aplică acoperiri catodice. Acest lucru se întâmplă dacă metalul de acoperire este un catod eficient în raport cu produsul și metalul de bază tinde să pasiveze. Polarizarea anodică rezultată pasivizează zonele neprotejate (în pori) ale metalului de bază și complică distrugerea lor. Acest tip de protecție electrochimică anodică se manifestă pentru acoperirile de cupru pe oțelurile 12X13 și 12X18H9T în soluții de acid sulfuric.
Principala metodă de aplicare a acoperirilor metalice de protecție este galvanizarea. De asemenea, sunt utilizate metode de difuzie termică și mecanotermică, precum și metalizarea prin pulverizare și imersie în topitură.
1.2 Galvanizare.
Metoda galvanică de depunere a acoperirilor metalice de protecție este foarte răspândită în industrie. Comparativ cu alte metode de aplicare a acoperirilor metalice, are o serie de avantaje serioase: eficiență ridicată (protecția metalelor împotriva coroziunii se realizează prin acoperiri foarte subțiri), posibilitatea obținerii acoperirilor aceluiași metal cu proprietăți mecanice diferite, controlabilitate ușoară a procesului (reglarea grosimii și a proprietăților depunerilor de metal prin modificări ale compoziției electrolitului și regimului de electroliză), posibilitatea obținerii aliajelor de diverse compoziții fără utilizarea temperaturilor ridicate, aderență bună la metalul de bază etc.
Dezavantajul metodei galvanice este denivelarea grosimii acoperirii pe produse cu profil complex.
Depunerea electrochimică a metalelor se efectuează într-o baie galvanică de curent continuu (Figura 45). Obiectul acoperit cu metal este atârnat pe catod. Plăcile din metalul depus (anodii solubili) sau dintr-un material insolubil în electrolit (anodii insolubili) sunt folosite ca anodi.
O componentă esențială a electrolitului este un ion metalic, care se depune pe catod. Compoziția electrolitului poate include, de asemenea, substanțe care îi cresc conductivitatea electrică, reglează procesul anodic, asigură un pH constant, surfactanți care cresc polarizarea procesului catodic, aditivi de strălucire și nivelare etc.
Figura 5 Baie de galvanizare pentru electrodepunere metalică:
1 - carcasă; 2 - carcasă de ventilație; 3 - bobină de încălzire; 4 - izolatori; 5 - tije anodice; 6 - tije catodice; 7 - bule pentru amestecarea cu aer comprimat
În funcție de forma în care ionul metalului de descărcare se află în soluție, toți electroliții sunt împărțiți în complexe și simple. Descărcarea ionilor complexi la catod are loc la o supratensiune mai mare decât descărcarea ionilor simpli. Prin urmare, precipitatele obținute din electroliți complecși au granulație mai fină și grosime uniformă. Cu toate acestea, acești electroliți au o eficiență mai mică a curentului metalic și densități mai mici de curent de funcționare, în performanță sunt inferioare electroliților simpli, în care ionul metalic este sub formă de ioni simpli hidrați.
Distribuția curentului pe suprafața unui produs într-o baie de galvanizare nu este niciodată uniformă. Acest lucru duce la o rată de depunere diferită și, în consecință, la grosimea stratului de acoperire în secțiuni individuale ale catodului. O variație deosebit de puternică a grosimii este observată la produsele cu un profil complex, care afectează negativ proprietățile de protecție ale acoperirii. Uniformitatea grosimii învelișului depus se îmbunătățește odată cu creșterea conductivității electrice a electrolitului, o creștere a polarizării cu o creștere a densității de curent, o scădere a randamentului curent al metalului cu o creștere a densității de curent și o creștere a distanței dintre catod și anod.
Capacitatea unei băi galvanice de a produce acoperiri uniform groase pe o suprafață de relief se numește capacitate de împrăștiere. Electroliții complexi au cea mai mare putere de împrăștiere.
Pentru a proteja produsele de coroziune, se folosește depunerea galvanică a multor metale: zinc, cadmiu, nichel, crom, staniu, plumb, aur, argint etc. Sunt utilizate și aliaje electrolitice, de exemplu, Cu - Zn, Cu - Sn, Sn - Bi și acoperiri multistrat.
Acoperirile anodice cu zinc și cadmiu protejează cel mai eficient metalele feroase (electrochimic și mecanic) de coroziune.
Acoperirile din zinc sunt utilizate pentru a proteja piesele mașinilor, conductele și tablele de oțel împotriva coroziunii. Zincul este un metal ieftin și ușor disponibil. Protejează produsul principal prin metode mecanice și electrochimice, deoarece în prezența porilor sau a petelor goale, zincul este distrus, iar baza de oțel nu se corodează.
Acoperirile de zinc domină. Cu ajutorul zincului, aproximativ 20% din toate piesele de oțel sunt protejate împotriva coroziunii, iar aproximativ 50% din zincul produs în lume este utilizat pentru galvanizare.
În ultimii ani, s-au dezvoltat lucrări pentru a crea acoperiri galvanice de protecție din aliaje pe bază de zinc: Zn - Ni (8 - 12% Ni), Zn - Fe, Zn - Co (0,6 - 0,8% Co). Astfel, este posibilă creșterea rezistenței la coroziune a acoperirii de 2-3 ori.