Walidacja produkcji leków. Weryfikacja i walidacja: co to jest w uproszczeniu? Jaka jest różnica między walidacją a weryfikacją? Cel walidacji analitycznej
Zgodnie z międzynarodową normą jakości ISO 9001: „Organizacja musi certyfikować wszystkie procesy realizacji produkcji i usług, gdy wynik końcowy nie może być zweryfikowany przez późniejsze monitorowanie lub pomiar, w wyniku czego braki można zidentyfikować dopiero po użyciu produktu lub świadczenie usługi.” Walidację należy przeprowadzać dla wszystkich procesów prowadzących do wytworzenia produktów i półproduktów przeznaczonych do użytku poza przedsiębiorstwem.
Walidacja to zestaw działań mających na celu potwierdzenie, że wszystkie procesy, systemy, sprzęt (w tym sprzęt pomiarowy), materiały i komponenty, operacje i procedury prowadzą do pożądanych rezultatów. W przypadkach, gdy w trakcie walidacji lub w wyniku jej wyników zaobserwowane wskaźniki są niezadowalające, wszystkie zaangażowane zasoby są automatycznie przenoszone do kategorii strat.
W niektórych sytuacjach produkt uzyskany w procesie walidacji nie może zostać przekazany klientowi z tego czy innego powodu (przy prowadzeniu badań niszczących lub, jeśli to konieczne, konserwacji samego produktu jako dowodu zdolności / ważności procesu), tj. niezależnie od wyników przynosi firmie straty. Dlatego identyfikacja przypadków wymagających walidacji lub rewalidacji jest ważną częścią pracy organizacji.
W tym artykule przyjrzymy się przypadkom, w których walidację należy przeprowadzić dla:
· ekwipunek
· proces
· produkt
Walidacja sprzętu
Wszyscy producenci sprzętu wskazują zestaw specyficznych cech swojego produktu. Obejmuje to dane dotyczące wymaganych warunków pracy, wagi, wymiarów geometrycznych, parametrów zasilania i wiele więcej. Dla użytkowników najciekawszy jest zakres działania, dokładność i stabilność. Ostatnie dwa parametry są najczęściej badane podczas walidacji jako najbardziej krytyczne dla jakości produktu.
Walidacja urządzeń polega na potwierdzeniu zgodności parametrów dokładności z deklarowaną specyfikacją. Dlatego też, jeśli sprzęt był instalowany po raz pierwszy, powinien zostać poddany walidacji. W przypadku niektórych typów sprzętu walidację należy również przeprowadzać po każdym ruchu.
Stabilność sprzętu określa częstotliwość powtarzania walidacji. W przypadku sprzętu, którego stabilność zmienia się w czasie, częstotliwość walidacji jest często określana przez producenta. W przypadku braku takich informacji częstotliwość walidacji należy określić na podstawie doświadczenia z podobnym sprzętem lub wymaganiami wewnętrznymi.
Częstotliwość walidacji sprzętu i kryteria oceny wyników mogą być również uzgodnione z klientem. W niektórych przypadkach walidację sprzętu należy przeprowadzać każdorazowo przed uruchomieniem lub po dłuższych przestojach.
Walidacja procesu
Walidacja procesu obejmuje potwierdzenie, że proces prowadzi do pożądanych wyników przy określonym poziomie stabilności. Walidację procesu należy przeprowadzać po uruchomieniu nowego procesu lub po wprowadzeniu zmian w już istniejącym. Należy pamiętać, że przy uruchamianiu nowej produkcji walidacja procesu jest częścią etapu NPI i dodatkowo może nie być przeprowadzana przy uruchamianiu produkcji masowej.
Wymagania dotyczące rewalidacji procesu, po wprowadzeniu zmian w procesie, są ustalane przez wewnętrzne wymagania organizacji lub w porozumieniu z klientem. W takich przypadkach zaleca się zwrócenie szczególnej uwagi na wyjaśnienie, co należy uznać za zmianę w procesie. Na przykład w niektórych przypadkach wymiana części urządzenia może również prowadzić do konieczności powtórzenia walidacji.
W przypadku niektórych rodzajów produkcji walidacja procesu jest przeprowadzana każdorazowo bezpośrednio przed uruchomieniem linii lub po długim przestoju. W takim przypadku walidacja jest najczęściej przeprowadzana według uproszczonego planu, ale oceniana według bardziej rygorystycznych kryteriów. Formalnie taki proces nie może być w ogóle uznany za walidację. Zamiast walidacji często używa się nazwy przebieg testowy lub kontrola pierwszych próbek.
Ponieważ jednym z głównych wskaźników procesu badanego podczas walidacji jest jego stabilność, powtórzenie walidacji, przy braku zmian w procesie, nie jest wymagane. Jednak częstotliwość walidacji procesów może być również negocjowana osobno z klientem lub określona przez wewnętrzne procedury organizacji.
Walidacja produktu
Walidacja produktu różni się od walidacji sprzętu i procesu tym, że uwzględnia cały łańcuch produkcyjny, tj. oznacza zarówno walidację sprzętu, jak i walidację procesu, ale ich nie zastępuje. Celem walidacji produktu jest potwierdzenie zdolności wszystkich procesów i operacji do wytworzenia wymaganego produktu.
Walidacja produktu może składać się z zestawu badań oceniających produkt jakościowo i ilościowo. Przy ocenie wskaźników ilościowych, zgodnie z wynikami pomiaru obserwowanych parametrów, obliczane są wskaźniki zdolności: Cp, Cpk, Pp, Ppk. Przy ocenie wskaźników jakości najczęściej kryterium jest całkowity brak wad (lub obecność określonej cechy) w obserwowanej liczbie produktów.
Walidacja produktu przeprowadzana jest na początkowych etapach produkcji i jest powtarzana w przypadku zmiany konfiguracji produktu lub przeniesienia produktu na inną linię/warsztat/zakład. W niektórych przypadkach walidacja produktu może zbiegać się z walidacją procesu. Na przykład przy rozpoczęciu produkcji nowego produktu na nowej linii produkcyjnej. W tym przypadku przez nową linię należy rozumieć konfigurację linii produkcyjnej zmontowanej bezpośrednio do wytworzenia danego produktu (serii produktów).
Na koniec rozważ przykład, aby lepiej zrozumieć różnicę między walidacją sprzętu, procesu i produktu.
Załóżmy, że przedsiębiorstwo przygotowuje się do uruchomienia produkcji nowej „rodziny" wyrobów. Do tego typu produkcji należy przygotować nową linię produkcyjną. Różnica między nową linią produkcyjną a istniejącą polega na dodaniu 2 sztuk wyposażenia Nowa linia produkcyjna zostanie utworzona na bazie poprzedniej poprzez dodanie dwóch jednostek - wyposażenie zainstalowanej linii nie przemieszcza się Dodatkowe wyposażenie linii będzie dostarczane z różnych miejsc: jedna jednostka zostanie dokupiona bezpośrednio od producenta (nowy sprzęt), a drugi będzie dostarczony z innego przedsiębiorstwa (sprzęt był wcześniej eksploatowany), aby klient otrzymał produkt spełniający jego wymagania?
Tak więc w przypadku dwóch urządzeń, niezależnie od tego, czy jest to sprzęt nowy, czy używany, należy przeprowadzić walidację. Rewalidacja sprzętu powinna być przeprowadzana w zależności od stabilności jego pracy.
Cały proces produkcyjny jest walidowany dla jednego z produktów. Rewalidacja procesu zostanie przeprowadzona zgodnie z wewnętrznymi procedurami i przepisami/wymaganiami klienta lub gdy w procesie zostaną wprowadzone zmiany.
Każdy produkt z całej rodziny powinien zostać poddany walidacji przed seryjną produkcją. Rewalidacja produktu powinna być przeprowadzana zgodnie z wymaganiami klienta, procedurami wewnętrznymi lub modyfikacjami produktu.
Definicja walidacji
Zgodnie z definicją PIC / Sto działania, które zgodnie z
z zasadami GMP udowodnić, że
pewna technika, proces,
sprzęt, surowce, czynności lub
system prowadzi do
oczekiwane rezultaty
Cel walidacji
Udowodnij, że obiekt jest walidowanynaprawdę prowadzi do
oczekiwane rezultaty Procedura procesu walidacji powinna:
być ustalone w wielu protokołach i
wyniki walidacji powinny być
zapisane w ewidencji lub raportach.
Dokumenty te są używane w różnych
formularze po otrzymaniu rejestracji
certyfikacja i inspekcja zgodnie z
Zasady GMP, a także wewnętrzne
cele produkcyjne do kierowania
organizacja może być pewna, że
kontroluje swoje procesy.
Plan działań walidacyjnych
jest dokumentem mającym wpływdziałalność produkcyjna wszystkich
przedsiębiorstw i określenie terminu walidacji
oraz wykazy sprzętu, systemów, metod i
procesy technologiczne, które podlegają
walidacja
Plan działań walidacyjnych powinien obejmować:
przedstawioneformat kompilacji dokumentu na
walidacja (w szczególności dla walidacji urządzeń i systemów z punktu
w zakresie uprawnień montażowych, uprawnień eksploatacyjnych i
kwalifikacje operacyjne; w sprawie walidacji technologicznej
proces; w sprawie walidacji wyników badań analitycznych), oraz
wyjaśniono również ilość informacji, które powinny znaleźć odzwierciedlenie w
każdy dokument.
wskazano przyczyny i termin przedłużenia walidacji;
kolejność walidacji w każdym
obszar produkcji
określone środki są określone w przypadku jakichkolwiek odchyleń od
wymienione testy i warunki, po których,
kolejna walidacja jest dozwolona
Walidacja procedur analitycznych
Walidacja metody analitycznej toproces, dzięki któremu, przez
testy laboratoryjne ustalają, że
charakterystyka metody odpowiada
wymagania prospektywnej analizy
testy, których głównym zadaniem jest
eksperymentalne dowody, że
ta technika jest odpowiednia do ich osiągnięcia
celów, do których jest przeznaczony.
Walidacja metody analitycznej
Walidacja jest udokumentowanaprocedura dająca wysoki stopień pewności
czy konkretny proces, metoda lub system
będzie konsekwentnie prowadzić do rezultatów,
spełnianie z góry ustalonych kryteriów
dopuszczalność.
Zgodnie z międzynarodowymi wymaganiami dotyczącymi
walidacja dowolnej metody analitycznej
opracowane lub zmodyfikowane
metoda analityczna powinna być oceniana z punktu
pod względem ważności i obiektywizmu jego
posługiwać się.
Cel walidacji analitycznej
- gwarantujemy, że wybrana metoda analitycznada powtarzalność i niezawodność
wyniki zgodne z celem.
Konieczne jest prawidłowe zdefiniowanie
zarówno warunki stosowania metodyki, jak i cel
do którego jest przeznaczony.
Metody analityczne stosowane do:
1. Identyfikacja substancji leczniczej.2. Ustalenie limitów zawartości zanieczyszczeń
krewni
znajomości,
ciężki
metale,
pozostały
rozpuszczalniki organiczne.
3. Ilościowe oznaczanie leków
substancje, substancja lecznicza (substancje) w
skład postaci dawkowania, indywidualny
zanieczyszczenia
oraz
sumy
zanieczyszczenie
produkty,
konserwanty.
Parametry walidacji metody analitycznej
DobrzePrecyzja
Specyficzność
Granica wykrywania lub czułość
Granica kwantyfikacji
Liniowość
Obszar analityczny (zakres)
Stabilność (odporność)
Dokładność, prawdziwość
metoda analityczna charakteryzuje bliskość wynikówtesty uzyskane tą metodą są prawdziwe
wartość.
Wskaźnikiem poprawności metody jest zwykle wartość
błąd systematyczny.
Błąd systematyczny jest wyrażony jako różnica między
matematyczne oczekiwanie wyników pomiarów i prawda
wartość.
Poprawność oceniana jest na podstawie co najmniej 9 wyników
oznaczenia na minimum 3 poziomach stężeń w limicie
obszar analityczny (np. 3 repliki definicji)
dla 3 stężeń analitycznych).
Precyzja
metodologia analityczna wyraża bliskośćwyniki (stopień rozproszenia) serii pomiarów,
uzyskane na wielu próbkach jednej próbki
w podanych warunkach.
Zazwyczaj badane są trzy poziomy precyzji:
- powtarzalność
- precyzja pośrednia
- odtwarzalność Powtarzalność jest miarą precyzji, biorąc pod uwagę to samo
warunki pracy przez krótki okres
czas, czyli w normalnych warunkach pracy
metoda analityczna przy użyciu tego samego sprzętu.
Wskaźnik ten jest czasami określany jako wewnątrzeksperymentalny.
precyzja (precyzja powtarzalności).
Zgodnie z zaleceniami ICH należy ocenić powtarzalność
wykorzystanie wyników co najmniej dziewięciu oznaczeń,
obejmujących określony zakres technik (np.
trzy stężenia / trzy powtórzenia jak w teście dla
poprawność) lub co najmniej sześć definicji
100% stężenie roztworu testowego.
Wymagana jest reprezentacja wyliczonego standardu.
odchylenie, względne odchylenie standardowe
Precyzja pośrednia - zmienność w obrębie
jedno laboratorium.
W tym przypadku normatywnymi wyznaczonymi parametrami są
to zmienność w ciągu dnia, analityka i sprzętu.
ICH
pozwala
nie
zdefiniować
mediator
precyzja,
Jeśli
udowodniony
odtwarzalność.
Zakłada się, że precyzja pośrednia powinna
wykazują zmienność tego samego rzędu wielkości lub mniejszą niż
zmienność odtwarzalności.
ICH zaleca raportowanie wartości normy
odchylenia,
względny
standard
odchylenia
(współczynnik zmienności) i przedział ufności. Odtwarzalność - mierzy międzylaboratoryjne
precyzja.
Ten parametr jest brany pod uwagę przy standaryzacji
metoda analityczna (na przykład podczas włączania
metody w farmakopei i transfer metody pomiędzy
różnych laboratoriach).
Aby potwierdzić tę cechę,
identyczne badania w różnych laboratoriach z wykorzystaniem
te same jednorodne próbki do badań i takie same
plan eksperymentu.
umiejętność rzetelnego określenia leku
substancja w obecności związków zanieczyszczeń,
produkty degradacji i substancje pomocnicze
Swoistość ocenia się podczas walidacji.
metody stosowane do:
- identyfikacja substancji leczniczych,
- definicje zanieczyszczeń (związków pokrewnych,
metale ciężkie, lotne zanieczyszczenia organiczne),
- ustalenie ilościowej zawartości substancji w
próbka i postać dawkowania.
Specyfika metody analitycznej
W badaniach tożsamości metoda analityczna powinna:zapewnić identyfikację substancji leczniczej w obecności
inne związki o podobnej budowie chemicznej. Powinno być
poparte uzyskaniem pozytywnych wyników (w porównaniu z
norma) analiza próbki zawierającej substancję leczniczą, oraz
również negatywne wyniki analizy próbki, która nie zawiera
taką substancję, aby potwierdzić, że wynik pozytywny nie jest
może wynikać z obecności innych podobnych struktur do niego
Substancje.
W przypadkach, gdy związki zanieczyszczeń i produkty degradacji nie są
zidentyfikowane lub brak materiałów odniesienia,
należy uzasadnić specyfikę metody analitycznej
wyniki oznaczeń inną, niezależną zwalidowaną metodą.
W takim przypadku analizowane próbki należy poddać stresowi
wpływy (światło, temperatura, wilgotność, kwas / zasada)
hydroliza, utlenianie).
Specyfika metody analitycznej
Nailościowy
definiowanie
zanieczyszczenia
Specyfikę metody można udowodnić dodając do
substancja lecznicza w odpowiednich ilościach
zanieczyszczenia lub zaróbki do udowodnienia
fakt, że obecność tych substancji nie wpływa na wynik
analiza.
Granica wykrywania (PO)
minimalna ilość analitu w próbce, która możebyć znalezionym, ale niekoniecznie zidentyfikowanym w
ilościowy
Poszanowanie
w
dany
warunki
eksperyment.
Granica wykrywalności jest wyrażona jako stężenie analitu.
w próbce, na przykład w procentach, części na milion (ppm) lub
części na miliard (ppb).
Granica wykrywania (PO)
Istnieje kilka podejść do definiowania oprogramowania:- podczas walidacji technik instrumentalnych zwykle występuje szum tła
porównaj zmierzone sygnały z próbek o znanych niskich stężeniach
analit z próbkami kontrolnymi (ślepymi).
Minimalne stężenie, przy którym można wiarygodnie określić analit, to
ustawić przy użyciu akceptowalnego stosunku sygnału do szumu 2:1, lub
3: 1. Przedłożenie odpowiednich chromatogramów jest wystarczające do uzasadnienia
wartości oprogramowania.
- innym podejściem jest obliczanie oprogramowania na podstawie odchylenia standardowego
odpowiedź i nachylenie krzywej kalibracji. Odchylenie standardowe jest określone przez
na podstawie odchylenia standardowego wielu wyników testów
próbki kontrolne (ślepe) lub na podstawie odchylenia standardowego wartości
odcinki odcięte krzywymi regresji na osi w zakresie przyjętego oprogramowania.
Taka ocena wymaga późniejszej walidacji poprzez przeprowadzenie oddzielnej
określenie odpowiedniej liczby próbek zawierających analit w ilości zbliżonej do lub
równe oprogramowanie:
PO = 3 / S, gdzie
st jest odchyleniem standardowym odpowiedzi; S to nachylenie krzywej kalibracji.
Granica ilościowa (SQD)
minimalne stężenie, przy którym analit może byćwiarygodnie obliczona ilościowo w stosunku
stosunek sygnał/szum 10:1.
W drugim podejściu POC określa się wzorem:
PKO = 10. / S
Na technikę POC ma wpływ czułość detektora i
dokładność przygotowania próbki przy niskich stężeniach zanieczyszczeń.
W praktyce TOC powinien być niższy niż zalecany ICH
granica zawartości zanieczyszczeń, których obecność jest konieczna
wskazać w dokumentacji rejestracyjnej.
Liniowość procedury analitycznej
to jest umiejętność (w określonym zakresie)uzyskaj wyniki testu w postaci zmiennych
(na przykład chłonność i powierzchnia pod
krzywa), wprost proporcjonalna do stężenia
(ilość analitu) próbki.
Zmienne, które można wykorzystać do
ilościowy
definicje
analizowane
substancje to pola wierzchołków, wysokość wierzchołków i
stosunek powierzchni (wysokości) pików analizowanych
substancji do piku wzorca wewnętrznego. Istnieją dwa podejścia do określania liniowości
techniki:
- w pierwszym różne ciężary są pobierane bezpośrednio
standardowa próbka do przygotowania roztworów różnych
stężenie w celu określenia liniowości. Ta metoda
nie nadaje się do przygotowywania roztworów o bardzo niskim poziomie
stężenie ze względu na wystarczająco duży błąd przy
ważenie;
- w drugim podejściu początkowe rozwiązanie wysokiej
stężenie. Liniowość jest określana na rozwiązaniach
otrzymany przez bezpośrednie rozcieńczenie oryginalnego standardu
rozwiązanie. Ta metoda jest najczęstsza i często
Zalecana. Należy stosować wyniki definicji
co najmniej pięć stężeń.
Na
normalna
warunki
liniowość
liczy się
do przyjęcia
w
współczynnik
determinacja
(kwadrat
współczynnik
korelacja)> 0,997.
Zgodnie z wymaganiami ICH również
należy obliczyć nachylenie krzywej,
suma kwadratów rezydualnych i wartość segmentu,
krzywa odcięcia wzdłuż osi y.
Zakres metody analitycznej
odstęp między maksimum a minimumstężenie analitu w próbce, dla
kogo
było
pokazane
do przyjęcia
poziom
precyzja,
poprawność
oraz
liniowość
technika analityczna. Zakres jest zwykle wyrażony w
te same jednostki (na przykład procent, części per
mln) jako wyniki badań uzyskane z
z wykorzystaniem technik analitycznych.
Do
techniki
ilościowy
definicje
farmaceutyczny
Substancje
lub
skończone
lek jest zwykle zalecany do
zakres wynosił 80-120% stężenia nominalnego.
umiejętność
metodologia
zostać
niezmieniony
w
mały,
ale
celowe zmiany parametrów
techniki;
Ona
przedstawia
Informacja
O
niezawodność w normalnym użytkowaniu.
Solidność (stabilność) metody analitycznej
Parametry zmienności:1. Przygotowanie próbki:
- czas ekstrakcji;
- rozpuszczalnik do przygotowania roztworu testowego (pH ± 0,05 jednostki,%
zawartość rozpuszczalnika organicznego ± 2% (ilość czystego rozpuszczalnika);
- filtry membranowe;
- stabilność obiektu testowego i próbek standardowych.
2. Warunki wysokosprawnej chromatografii cieczowej (HPLC):
- skład fazy ruchomej (pH ± 0,05 jednostki,% zawartości organicznej)
rozpuszczalnik ± 2% (ilość czystego rozpuszczalnika);
- użyta kolumna (kolumny równoważne, serie i/lub dostawcy, wiek)
kolumny);
- temperatura;
- Przepływ.
3. Warunki chromatografii gazowej (GC):
- używana kolumna (seria i/lub dostawcy, wiek);
- temperatura;
- Przepływ.
Klasyfikacja metod stosowanych dla produktów farmaceutycznych
Metody analityczne stosowane do kontroli jakościleki są generalnie podzielone na 4 klasy:
- klasa A - testy mające na celu ustalenie autentyczności
zarówno substancja lecznicza, jak i poszczególne składniki w postaci gotowej
produkt leczniczy;
- klasa B - metody przeznaczone do wykrywania i
ilościowe oznaczanie zanieczyszczeń jak w lecznictwie
substancja, a w gotowym
postać dawkowania;
- Klasa C - Metody stosowane do oceny ilościowej
substancja lecznicza lub główny składnik gotowego produktu
produkt leczniczy;
- klasa D - metody stosowane do oceny cech gotowych
leki, takie jak „wskaźniki rozpuszczalności” i
„Jednorodność dawkowania”. W tabeli przedstawiono cechy, które są brane pod uwagę
różne klasy technik, tj. znaczenie parametrów walidacji
Tabela 1 - Charakterystyka stosowana przy określaniu różnych wskaźników
jakość leków
Nazwa
cechy charakterystyczne
Autentyczność
Dobrze
Precyzja
Niezawodność
Liniowość i
Zasięg
Selektywność
Limit
Wykrycie
Limit
ilościowy
definicje
Wskaźniki jakości
Definicja Charakterystyka ilościowa
zanieczyszczenia
definicja
FPP
(rozpuszczenie,
jednolitość,
dawkowanie)
+
+
+
+
+
+
+
-
+
+
+
+
+
+
+
+
Test
do granic
+
+
+
+
+
-Czyli np. przy ustalaniu autentyczności jest to ważne
zdolność techniki do określenia minimalnej ilości
substancji i nie reagują na zmieniające się warunki i
obecność innych składników w preparacie, tj. szczególny
granica wykrywalności, niezawodność i
selektywność.
W ilościowym oznaczaniu leku
ważna jest bliskość wyników do prawdziwej wartości,
stopień rozrzutu wyników, zdolność do nieodpowiadania
zmiana
warunki,
dawać
wyniki,
bezpośrednio
proporcjonalny
Ilość
Substancje
v
próbka,
umiejętność określenia minimalnej ilości substancji,
te. poprawność, dokładność, niezawodność, liniowość i
Granica wykrywalności. Te ogólne zasady mogą mieć:
wyjątki,
gdy
specyfikacje,
oznaczone w tabeli jako niewymagane mogą
być konieczne i na odwrót.
Ponadto wybór cech i
na głębię ich badania ma wpływ cel,
dla których podana jest metodologia.
Rodzaje walidacji
Walidacja dzieli się na następujące typy:- obiecujący;
- towarzyszący;
- retrospektywa;
- rewalidacja.
Walidacja perspektywiczna
realizowany przez CPL i OKK na etapie przygotowania projektuFSP dla nowych leków lub podczas rewizji FSP, jeśli:
wprowadzony
Nowy
analityczny
techniki.
JESTEM,
opracowany przez CPL dla projektów FSP dotyczących leków,
są wstępnie walidowane w licencji CPL. Wtedy oni
są poddawane badaniom walidacyjnym w QCD dla
potwierdzenie i porównanie wyników walidacji.
Podczas walidacji każdej AM w QCC jest to konieczne
powtórzyć główną część badań walidacyjnych,
przy użyciu precyzyjnych eksperymentów i
Prawidłowy.
Towarzysząca walidacja
odbyła się w Laboratorium Centralnym i OCC na etapie przygotowańprojekt FSP zamiast istniejącego FS (VFS), jeśli:
poprzednie badania walidacyjne dla AM,
zawarte w FS (VFS) nie zostały przeprowadzone.
Wszystkie metody podczas walidacji
badania powinny wykazać brak
wpływ innych składników badanej próbki na
wyniki oznaczenia analitu.
Walidacja retrospektywna
odbywa się w OCC metodąkarty kontroli jakości. Ten rodzaj walidacji
AM stosuje się pod warunkiem, że skład leku,
proces technologiczny i metodologia
kontrola jakości pozostanie bez zmian.
przeprowadzane w wielu przypadkach, gdy występuje
zmiany w syntezie substancji leczniczej, w składzie
gotowy lek i zmiany w samej metodzie. Rewalidacja
dzieli się na dwie kategorie:
- rewalidacja po znanej zmianie, która
może wpływać na jakość produktu (w tym transfer
proces z jednego przedsiębiorstwa do drugiego lub z jednego
spisek na inny);
- rewalidacja okresowa, realizowana zgodnie z harmonogramem
przez pewne
odstępy czasu.
Rewalidacja AM (rewalidacja)
Rewalidacja jest przeprowadzana w przypadku następujących zmian:a) dostawcy surowca (zmiana właściwości fizycznych surowca)
surowce, takie jak gęstość, lepkość, wielkość cząstek itp., mogą mieć wpływ
właściwości mechaniczne surowców, a w rezultacie niekorzystnie wpływają
proces lub produkt docelowy);
b) podstawowe materiały opakowaniowe (na przykład zastosowanie polimeru)
materiały zamiast szkła mogą wymagać zmian w procesie
pakowanie, używanie innego sprzętu, prowadzenie badań
stabilność itp.);
c) wymagania regulacyjne dotyczące jakości gotowego produktu;
d) objętość partii;
e) skład gotowego produktu;
e) kryteria oceny procesu;
g) w trakcie procesu technologicznego;
h) sprzęt (wymiana sprzętu i jego naprawa; przebudowa i/lub)
naprawa obiektów przemysłowych i systemów inżynieryjnych).
Rewalidacja AM (rewalidacja)
Rewalidacja powinna być również wykonana:- gdy pojawiają się odchylenia podczas produkcji seryjnej
produkty;
- przy przenoszeniu procesu do innej produkcji lub do innej
wątek;
- w przypadku nieoczekiwanych zmian, które mogą być
zidentyfikowane w
samokontrola.
Wyniki walidacji są udokumentowane w protokole na
walidacja.
Protokół walidacji sporządzany jest oddzielnie dla każdego gatunku.
technika analityczna.
Walidacja systemów i urządzeń produkcyjnych
Ostatnio stało się to standardową praktykąwłączenie procedury „kwalifikacyjnej” w ramach
"Walidacja". PIC/S definiuje „kwalifikację” jako
identyfikacja właściwości sprzętu związanych z
wykonywanie funkcji specjalnych i definicja
określone limity lub ograniczenia danych
nieruchomości.
Wymagania dotyczące systemów i sprzętu
- systemy i urządzenia są odpowiednie do zamierzonychposługiwać się
v
konformizm
z
rozwinięty
dokumentacja;
- prawidłowo zainstalowane systemy i urządzenia,
zgodność z dokumentacją deweloperską;
- systemy i urządzenia wyposażone są w odpowiednie
instrukcje i procedury (na przykład dotyczące konserwacji i
naprawa, kalibracja, czyszczenie) niezbędne do
wykonywanie pracy;
- systemy i urządzenia działają w normalnych warunkach
warunki, a w przypadku „najgorszych przypadków” w granicach,
określone w dokumentacji rozwojowej.
Przed przystąpieniem do walidacji procesu należy przeprowadzić kwalifikację krytycznych urządzeń i systemów. Kwalifikacje są zwykle
realizowane w następujących etapach:kwalifikacja projektowa (DQ) - dotyczy okresu przed instalacją
ekwipunek. Określa działanie
i specyfikacje funkcjonalne / wymagania
do sprzętu i części rozsądnych
decyzje w wyborze dostawcy.
Kwalifikacja projektowa (DQ)
Ten etap obejmuje:- wybór dostawcy, postępuj zgodnie z poniższymi wskazówkami
kryteria: obecność w nomenklaturze produkcji lub
dostawa urządzeń wymaganego typu, technicznych
poziom produktów i reputacja dostawcy na rynku,
obecność przedstawiciela w Rosji i porządek
wspierać urządzenie w działaniu.
- wybór żądanego urządzenia
- dobór akcesoriów dodatkowych (opcje).
Wszystko to odbywa się przed podjęciem decyzji o zakupie.
Kwalifikacja instalacyjna (Kwalifikacja instalacyjna - IQ)
odnosi się do instalacji sprzętu i określa, że otrzymanysprzęt spełnia swoje przeznaczenie i wymagania dla niego,
czy jest prawidłowo zainstalowany w wybranej konfiguracji oraz
co jest odpowiednie do pracy. Przeprowadza się to w następujących przypadkach:
zakup nowego lub używanego urządzenia,
przenoszenie instrumentu z jednego miejsca w inne w przedsiębiorstwie.
Wykonywana po dostarczeniu urządzenia do miejsca użytkowania. W której:
- sprawdzana jest zgodność dostarczonego sprzętu z zamówieniem i
kompletność dostawy, w tym dokumentacja;
- przygotowywane jest miejsce na instalację sprzętu (fakt, że sprzęt)
może być umieszczony w przeznaczonej dla niego przestrzeni, musi być
sprawdzane przy składaniu zamówienia);
- dostawa niezbędnej komunikacji (energia elektryczna,
woda, sprężone powietrze itp.).
Kwalifikacja operacyjna (OQ)
proces,seans,
Co
ekwipunek
Wola
funkcjonować zgodnie z wymaganiami pracy/operacyjnymi dla
go w wybranej konfiguracji. Walidacja OQ jest wykonywana, gdy
pod warunkiem pomyślnego zakończenia walidacji sprzętu IQ. Ona
można w całości lub częściowo połączyć z IQ w oparciu o
konkretne ustawienie. Lista prac może obejmować: rozpakowanie,
montaż i instalacja sprzętu do tego przeznaczonego,
miejsce zgodnie z wymaganiami producenta (wykonane
przedstawiciel
producent,
specjalistyczne
organizacja lub użytkownik, jeśli to konieczne
przygotowanie); sprawdzanie stałych (niezmiennych) parametrów
kontrole przyrządów, oprogramowania i funkcjonalności
(wykonane zgodnie z instrukcją producenta).
Kwalifikacja operacyjna (kwalifikacja operacyjna - PQ)
proces pokazujący, że sprzętstale eksploatowane zgodnie z
specyfikacja - warunki odpowiednie do jego
rutynowe użytkowanie. Trwa walidacja PQ
pod warunkiem pomyślnego ukończenia IQ i OQ. Ona
zaprojektowany w celu potwierdzenia prawidłowego działania
urządzenie w warunkach pracy. Zakres pracy
może zawierać testy funkcjonalności
za pomocą testów kontrolnych, testów OQ,
ale w rozszerzonym zakresie pr. V
dalej,
w
eksploatacja,
badanie
operatywność
wykonywane
na
instrukcje
producenta w regularnych odstępach czasu. Możliwy
różne opcje, na przykład sprawdzanie przed każdym
użyj w razie potrzeby. Użytkownik
powinnam
ołów
archiwum
dane
O
czeki
sprawność urządzenia i jego działanie, co może
służyć jako podstawa do walidacji
określenie częstotliwości kontroli.
Po pełnym zakwalifikowaniu sprzętu możemy
przejść do walidacji metod analitycznych.
1. Firma farmaceutyczna musi mieć
zidentyfikowano pracownika odpowiedzialnego za walidację,
kto tworzy grupę roboczą i ją powołuje?
głowa. Lider zespołu opracowuje plan
walidacja z maksymalnym uwzględnieniem skumulowanego
wcześniejsze informacje.
Plan musi być uzgodniony przez wszystkich zainteresowanych
działy (projektowe, projektowe, badawcze, produkcyjne, kontrolne)
jakości) i zatwierdzone przez osobę odpowiedzialną za
przeprowadzanie walidacji.
2. Grupa robocza i przedstawiciele zainteresowanych
działy wykonujące prace walidacyjne są
odpowiedzialność za jego realizację zgodnie z planem.
Przetwarzanie i prezentacja wyników walidacji
3. Personel zaangażowany w prace nad wykonaniemwalidacja musi przejść odpowiednie szkolenie
(instrukcja).
4. Raport z walidacji powinien zawierać:
-bramka;
- informacje ogólne;
- informacje o wzorcowaniu przyrządów pomiarowych;
- protokoły wyników uzyskanych w celu weryfikacji zgodności
instalacja, sprawność i warunki sprzętu oraz
parametry procesu do specyfikacji i
dokumentacja regulacyjna;
- analiza uzyskanych wyników, propozycji i wniosków;
- wymagania powtórnego testu.
Przetwarzanie i prezentacja wyników walidacji
Na podstawie uzyskanych wynikówszef grupy roboczej przygotowuje raport z
przeprowadzanie walidacji.
Pracownik odpowiedzialny za prowadzenie
walidacja, zatwierdzenie raportu i wydanie
wniosek
O
konformizm
obiekt
(sprzęt, proces technologiczny itp.)
wymagania
normatywny
i / lub
dokumentacja technologiczna.
Przykładowa treść raportu walidacyjnego (zalecane)
1. Przedmiot walidacji i jego identyfikacja, data (okres) i miejsce.2. Cel i rodzaj walidacji.
3. Identyfikacja walidatorów (imię i nazwisko, stanowisko, podpis, data);
4. Informacje ogólne:
4.1. Ogólna charakterystyka obiektu, w tym parametry krytyczne.
4.2. Wykaz dokumentacji (przepisy, artykuły farmaceutyczne, dokumentacja projektowa, instrukcje,
specyfikacje, certyfikaty, paszporty itp.).
4.3. Lista metod badawczych (pomiary, pobieranie próbek itp.) oraz kryteria oceny
wyniki.
4.4. Informacje o zaangażowanych organizacjach lub ekspertach.
5. Informacje o kalibracji/weryfikacji:
5.1. Przyrządy pomiarowe (przyrządy, czujniki, wagi itp.) zainstalowane w urządzeniach, inżynierii
systemy, pomieszczenia itp.
5.2. Przyrządy pomiarowe stosowane w walidacji/kwalifikacji.
6. Dokumenty:
6.1. Protokoły walidacji dla wszystkich etapów kwalifikacji (DQ, IQ, OQ, PQ) oraz walidacji procesu (PV),
lub link do nich wskazujący miejsce przechowywania.
6.2. Protokoły (raporty itp.) z danymi i wynikami badań, pobierania próbek itp.
7. Analiza uzyskanych wyników, m.in. na:
7.1. Weryfikacja krytycznych warunków i parametrów.
7.2. Zidentyfikowane odchylenia (zmiany) wymagające działań naprawczych.
7.3. Warunki bezpieczeństwa i higieny pracy.
8. Wnioski z wyników walidacji.
9. Czas powtórnej zaplanowanej walidacji.
INSTRUKCJE
PRAKTYCZNE (SEMINARIA)
ZAJĘCIA
Kurs 4
Dyscyplina: PODSTAWOWY PROJEKT I SPRZĘT PRODUKCYJNY
Opracowany przez:
Murzagaliewa E.T.
Ałmaty, 2017
Lekcja praktyczna numer 11
Walidacja procesu i kwalifikacja sprzętu produkcyjnego.
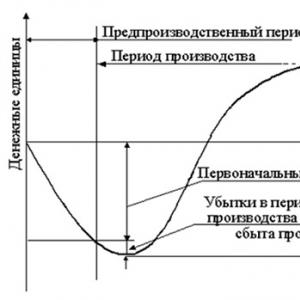
Walidacja procesu jest procedurą dokumentowania potwierdzającego, że określony proces (np. wytwarzanie produktów farmaceutycznych) pozwala, z wysokim stopniem pewności, wytworzyć produkt spełniający ustalone wskaźniki jakości (specyfikacje).
Walidacja jest integralną częścią starannie zaplanowanego, spójnego programu rozwoju produktu/procesu
Walidacja to działania, które zgodnie z zasadami dobrej praktyki produkcyjnej dowodzą, że określona metoda, proces, sprzęt, surowiec, czynność lub system rzeczywiście prowadzą do oczekiwanych rezultatów (Wytyczne EU GMP).
Kwalifikacja to proces dokumentacyjnego potwierdzenia, że projekt miejsca produkcji (system inżynieryjny, sprzęt, magazyn itp.) jest zgodny z przypisaniem projektowym (Specyfikacja wymagań użytkownika, URS) i wymaganiami GMP.
Zakres zastosowania - przedmioty kwalifikacji i walidacji:
Systemy techniczne
Lokal
Ekwipunek
Inżynieria (techniczna) systemów zapewniających funkcjonowanie produkcji
Proces technologiczny
Techniki kontroli jakości
Techniki czyszczenia
Podejścia:
Nowe procesy technologiczne
Walidacja po wprowadzeniu zmian
Planowana krytyczna rewalidacja
Rodzaje walidacji:
Walidacja perspektywiczna
o przed sprzedażą wydanych produktów
Towarzysząca walidacja
o podczas produkcji seryjnej
Walidacja retrospektywna
o procesy działają już od jakiegoś czasu
Główne zadania walidacji:
Potwierdzenie prawidłowości regulowanych parametrów procesów technologicznych - zapewnienie jakości wyrobów podczas realizacji technicznych operacji procesowych;
Potwierdzenie poprawności instrukcji realizacji operacji procesu technicznego (zgodność z możliwościami i przeznaczeniem sprzętu);
Potwierdzenie zdolności sprzętu do zapewnienia zgodności wszystkich parametrów procesów technicznych i jakości produktu;
Potwierdzenie zdolności (zdolności) personelu do zapewnienia spełnienia (zgodności) regulowanych wymagań;
Odtwarzalność (dokładność odwzorowania) parametrów procesu technicznego i zapewnienie niezbędnych wskaźników jakości.
Ogólne wymagania i zasady:
Środki techniczne (pomieszczenia, urządzenia, instalacje) są kwalifikowane
Zwalidowane metody analityczne
Proces jest dobrze zaprojektowany i zweryfikowany
Personel zaangażowany w testy walidacyjne jest przeszkolony
Zmiana jest napędzana
Zapewnienie częstotliwości oceny środków technicznych, systemów, urządzeń, procesów w celu potwierdzenia ich prawidłowego funkcjonowania


Kwalifikacja urządzeń i systemów inżynierskich gwarantuje, że urządzenia i systemy inżynieryjne odpowiadają ich przeznaczeniu funkcjonalnemu, stabilnie utrzymują parametry procesu technologicznego, którego potrzebujemy, oraz nie wprowadzają żadnych zanieczyszczeń do produktu. Zakres uprawnień ustalany jest na podstawie krytyczności obiektu infrastrukturalnego.
Krytyczne procedury czyszczenia są niezbędne do osiągnięcia wymaganej jakości powierzchni sprzętu i poziomu czystości, co z kolei pozwala uniknąć zanieczyszczenia produktu. Ponadto wyniki walidacji czyszczenia pozwalają zrezygnować z laboratoryjnej kontroli wód myjących i płuczących po każdym cyklu mycia, co znacznie oszczędza czas przy przejściu na produkcję innego leku.
Zastosowanie walidacji w przemyśle farmaceutycznym wynikało z zapożyczonego doświadczenia przemysłu lotniczego w 1960 r. Po raz pierwszy zastosowano go do walidacji procesów sterylizacji i produkcji stałych postaci dawkowania. Wkrótce potem walidacji poddano praktycznie wszystkie procesy wytwarzania leków.
1987 - FDA publikuje wytyczne dotyczące walidacji procesu.
W chwili obecnej walidacja jest obowiązkową częścią GMP.
Proces walidacji można porównać do praktyki prawniczej – tak samo, jak prawnik udowadnia poprawność swojego klienta, a inżynierowie walidacji, wykorzystując wyniki badań, udowadniają przydatność produkcji do wytwarzania produktów wysokiej jakości.
Walidacja... Przypadki specjalne:
- Kwalifikacja - działania, które potwierdzają, że dany sprzęt działa poprawnie i faktycznie prowadzi do oczekiwanych rezultatów. (wytyczne UE dotyczące dobrej praktyki wytwarzania).
- Walidacja analityczna (AV) jest udokumentowanym potwierdzeniem, że zatwierdzona metoda kontroli jest odpowiednia do stosowania w produkcji i kontroli jakości produktów leczniczych.
- Walidacja czyszczenia (CV) — udokumentowane dowody, że zatwierdzona procedura czyszczenia zapewnia poziom czystości sprzętu wymagany do produkcji leków.
- Walidacja Procesu (PV) jest dokumentalnym potwierdzeniem, że proces wykonany w założonych parametrach jest wydajny i o powtarzalnych parametrach, wytwarzając lek spełniający wszystkie określone wymagania dla produktu i jego jakości.
Jak widać kwalifikacja jest pojęciem węższym, w przeciwieństwie do walidacji, i wyznacza odrębny kierunek, który dotyczy badania parametrów systemów inżynierskich, obiektów produkcyjnych, wyposażenia technologicznego i laboratoryjnego oraz innych środków technicznych na zgodność z wymaganiami GMP i innymi dokumenty regulacyjne regulujące bezpieczną produkcję leków o wymaganej jakości.
Etapy kwalifikacji:
- Kwalifikacja projektu (DQ) to proces dokumentacyjnego potwierdzenia, że projekt produkcyjny (system inżynieryjny, sprzęt, magazyn itp.) jest zgodny z przypisaniem projektu (Specyfikacja wymagań użytkownika, URS) i wymaganiami GMP.
- Kwalifikacja Instalacyjna (IQ) jest dokumentowym potwierdzeniem, że instalacja pomieszczeń, systemów i urządzeń (zainstalowanych lub zmodyfikowanych) odbywa się zgodnie z projektem i pozostałą dokumentacją techniczną.
- Kwalifikacja operacyjna (OQ) - dokumentacja potwierdzająca, że pomieszczenia, systemy i urządzenia (zainstalowane lub zmodyfikowane) działają zgodnie z wymaganiami, we wszystkich trybach eksploatacji.
- Kwalifikacja Wykonawcza (PQ) jest dokumentalnym potwierdzeniem, że pomieszczenia, systemy i urządzenia w kompleksie pracują wydajnie i z powtarzalnymi wskaźnikami zgodnie z przepisami przemysłowymi, instrukcjami technologicznymi i specyfikacjami produktu.
Rodzaje walidacji procesów:
- Walidacja prospektywna - Walidacja wykonywana przed rozpoczęciem masowej produkcji wyrobów przeznaczonych do sprzedaży.
- Walidacja współbieżna - walidacja przeprowadzana podczas seryjnej produkcji wyrobów przeznaczonych do sprzedaży.
- Walidacja retrospektywna - certyfikacja procesu produkcji seryjnej sprzedawanego produktu na podstawie danych uzyskanych z produkcji i kontroli partii produktów.
- Ponowna walidacja - powtórzenie wstępnej walidacji procesu w celu zapewnienia, że zmiany w procesie (urządzeniu) dokonane zgodnie z procedurą kontroli zmian nie obniżą wydajności procesu i jakości produktu.
Rewalidacja (rewalidacja) przeprowadzana jest:
- w zaplanowany sposób w terminie określonym przez przedsiębiorstwo w Raporcie Walidacyjnym.
- przed wznowieniem produkcji w przypadku zmian w dokumentacji i/lub warunkach produkcji, które mogą mieć wpływ na jakość półproduktu i produktu gotowego. Zakres prac walidacyjnych określa przedsiębiorstwo na podstawie dokonanych zmian.
W oparciu o powyższą terminologię można zauważyć, że pojęcia walidacji „prospektywnej”, „skojarzonej” i „retrospektywnej” odnoszą się wyłącznie do procesów produkcyjnych produktów przeznaczonych do sprzedaży. Jednak użycie tych terminów przy organizowaniu i planowaniu walidacji innych rodzajów procesów zostało już podane i jest skutecznie wykorzystywane przez służby walidacyjne.
Planowanie walidacji
Wymagania GMP wymagają od producentów określenia, jakie prace walidacyjne są wymagane do wykazania kontroli krytycznych aspektów określonych operacji, które wykonują. Należy poddać walidacji istotne zmiany środków technicznych, sprzętu i procesów, które mogą wpłynąć na jakość produktów. Do określenia zakresu i zakresu walidacji należy zastosować podejście oparte na ryzyku.
Wszystkie działania walidacyjne powinny być zaplanowane. Kluczowe elementy programu walidacji powinny być jasno określone i udokumentowane w głównym planie walidacji (VMP) lub dokumentach powiązanych (wytyczne EU GMP).
Charakterystyczną cechą prac walidacyjnych jest konieczność wspólnej pracy specjalistów o różnych profilach: farmaceutów, technologów, inżynierów, metrologów itp. Zazwyczaj prace walidacyjne odbywają się w krótkich ramach czasowych. Prowadzenie badań walidacyjnych jest kosztowne, gdyż wymaga zaangażowania wysoko wykwalifikowanych specjalistów, zakupu określonego sprzętu itp.
Wszystkie te czynniki wymagają kompetentnego planowania, właściwej organizacji, dla jasnej i spójnej realizacji prac walidacyjnych.
Polityka walidacji
Należy udokumentować ogólną politykę producenta dotyczącą intencji i podejścia do walidacji, w tym walidację przepływów pracy, procedury czyszczenia, metody analityczne, procedury testów sprawdzających podczas produkcji, systemy komputerowe oraz w odniesieniu do osób odpowiedzialnych za opracowywanie, weryfikację, zatwierdzanie i dokumentowanie każdego etap walidacji.
Parametry/cechy krytyczne powinny być zasadniczo określane na etapie opracowywania lub w oparciu o wcześniejsze doświadczenia; należy również określić zakresy tych krytycznych parametrów/właściwości potrzebnych do powtarzalnych operacji. W takim przypadku konieczne jest:
- określić krytyczne cechy API jako produktów;
- wskazać parametry procesu, które mogą wpływać na krytyczne cechy jakościowe API;
- Ustal zakres dla każdej krytycznej zmiennej procesowej, która będzie wykorzystywana w produkcji seryjnej i kontroli procesu.
Walidacja powinna obejmować te operacje, które zostały zidentyfikowane jako krytyczne dla jakości i czystości API (wytyczne UE GMP).
Walidacja to szeroka i uogólniona koncepcja mająca na celu wykazanie stopnia zapewnienia jakości produktu poprzez testowanie procesów technologicznych, systemów inżynieryjnych, sprzętu, urządzeń produkcyjnych, technik sterowania itp. Proces ten jest logicznie powiązany i pokrywa się z wieloma naukami podstawowymi (chemia, fizyka, matematyki itp. itp.), które pozwalają nam bardziej szczegółowo rozważyć właściwości leków, surowców, z których są wykonane, etapy przetwarzania aż do uzyskania gotowego produktu oraz pomagają zidentyfikować i ocenić najbardziej krytyczne operacje , w których niespójności pociągną za sobą nieodwracalne konsekwencje, zapobiegając tym samym pojawieniu się na rynku leku niskiej jakości.
Literatura:
Główny:
1. Podstawy projektowania produkcji chemicznej: Podręcznik dla uczelni / wyd. AI Michajliczenko. - M.: MCK "Akademkniga" 2010. - 371 s.
2. Technologia czystych pomieszczeń. Podstawy projektowania, testowania i eksploatacji / W. White. - Wydawnictwo "Klinrum", 2008.
3. Projektowanie czystych pomieszczeń. Wyd. W. Biały. Za. z angielskiego - M.: wyd. "Klinrum", 2004. - 360 stron.
4. Podstawy projektowania produkcji chemicznej: Podręcznik. zasiłek / Butler S.I., Kormiltsin G.S., Kalinin V.F. - M .: Wydawnictwo „Inżynieria-1”. 2005.280 s.
5. Reglamentacja produkcji farmaceutycznej. Zapewnienie jakości produktu / V.V.Beregovykh, A.P. Meshkovsky. - M .: Wydawnictwo JSC "Agencja informacyjno-wydawnicza" Remedium ", 2001. - 527 s.
Dodatkowy:
1. Projekt architektoniczny: podręcznik dla studentów. Środa prof. Edukacja / MI Tosunova, MM Gavrilova. - wyd. 4, ks. i dodaj. - M.: Centrum Wydawnicze „Akademia”, 2009r. - 336 s.
2. Duża książka informacyjna o konstrukcjach i materiałach nowoczesnych budynków, 2006 r. - 620 s.
3. СТРК 1617. Dobra Praktyka Wytwarzania (GMP).
4. Spitsky O.R., Aleksandrow O.V. GEP - Dobra Praktyka Inżynierska. Przepis. - nr 2 (88). - 2013 .-- S. 7-14.
5. Spitsky OR Dobra Praktyka Inżynierska (GEP) jako system. zarządzanie inżynieryjne. Przemysł farmaceutyczny. - nr 6 (29). - 2011r. - S. 50-53.
6. Allen E., Iano J. Podstawy konstrukcji budowlanych: materiały i metody, wydanie 6. - Hoboken, New Jersey: John Wiley & Sons, Inc., 2014 .-- XVI, 1007 s.
7. Hicks Tyler G. Handbook of Civil Engineering Calculations, wydawca: McGraw-Hill Publikacja: 2007, angielski Isbn: 9780071472937 Strony: 840
Witajcie drodzy czytelnicy serwisu blogowego. Słowa walidacja i weryfikacja pojawiły się w języku rosyjskim stosunkowo niedawno (w przeciwieństwie do np. lub) wraz z międzynarodowymi standardami rozwoju i akceptacji produktów i technologii. W związku z tym, jak zwykle, istnieje pewne zamieszanie związane z tłumaczeniem terminów technicznych na język rosyjski i ich interpretacją.
Oprócz bezpośrednio procesów technologicznych, weryfikacja i walidacja słów są aktywnie wykorzystywane w Internecie, na przykład podczas rejestracji w systemach płatności (itp.), gdzie w celu powiązania karty plastikowej z kontem czasami konieczne jest przejście przez proces jej weryfikacji (weryfikacji). Właściciele witryn wiedzą, co jest w specjalnej usłudze zgodności.
Możesz również zainteresować się znaczeniem słowa walidacja, ponieważ po wejściu do Kontaktu, Mój świat lub Koledzy z klasy wyskakuje okno z prośbą zdać weryfikację konta wpisując numer telefonu lub wysyłając SMS. Z reguły jest to wynik działania wirusa, który zainfekował twój komputer, więc nieco poniżej poruszymy ten temat, a także opcje jego rozwiązania.
Czym jest weryfikacja i czym różni się od walidacji?
Spróbuję wyjaśnić prostymi słowami znaczenie pierwotnie osadzone w tych słowach, ponieważ techniczne tłumaczenie, które można znaleźć na przykład na Wikipedii (weryfikacja i walidacja) jest mało przydatne, jeśli nie jesteś ekspertem w tej dziedzinie i masz nigdy nie spotkałem się z czymś takim ...
Więc jakie są te podchwytliwe słowa? Jak już powiedziałem, bezpośrednie tłumaczenie interpretacji terminów prowadzi do tego, że walidacja i weryfikacja wydają nam się słowami synonimicznymi i oznaczają weryfikację (w rzeczywistości na poziomie codziennym często tak jest). Jest jednak różnica między nimi a kardynalną.
Spróbuję wyjaśnić różnicę dla ogólnego rozwoju. Słowo weryfikacyjne(z angielskiego weryfikacja) oznacza weryfikację lub testowanie. Niezależnie od tego, jaki proces technologiczny podejmiesz (wytwarzanie produktu mechanicznego, pisanie oprogramowania itp.), weryfikacja będzie oznaczać sprawdzenie poprawności i jakości wszystkich etapów produkcji. Jeżeli rower został zmontowany, sprawdzona zostanie obecność wszystkich niezbędnych elementów (kierownica, pedały, rama itp.) oraz ich zgodność z parametrami jakościowymi określonymi w specyfikacji istotnych warunków zamówienia.
Słowo walidacja(z angielskiej walidacji) jest najbliżej pojęcia certyfikacji, a w rzeczywistości oznacza kompleksowe sprawdzenie produktu we własnym zakresie zgodnie z wymaganiami klienta. Jeśli rower został zmontowany, to po przejechaniu nim przez przedstawicieli klienta zostanie on zweryfikowany i uzna, że spełnia on ich „życzenia”.
Jaka jest różnica? Można powiedzieć, że walidacja to testowanie produktu pod kątem fizycznej funkcjonalności w procesie przekazania go klientowi (czy rower jeździ czy nie - testy są przeprowadzane), a weryfikacja to te same testy, ale "papierowe" na zgodność produktu do specyfikacji technicznej (tak samo obecność pedałów, kół i kierownicy na rowerze), a odbywa się to jeszcze przed przekazaniem produktu lub oprogramowania klientowi.
Jest to niewątpliwie rażące uproszczenie, ale pomaga wyjaśnić różnicę między pojęciami prostymi i dostępnymi dla wszystkich słów.
Kolejny „niegrzeczny” przykład... Powiedzmy, że opracowano nowy lek. Jego formuła i TK zostają przeniesione do fabryki. Na zakończenie prac wykonawca sprawdza (weryfikuje) jego skład chemiczny i jakość pod kątem zgodności z SIWZ (SIWZ). Klient waliduje otrzymany lek, testując jego działanie na pacjentach lub myszach. Jeśli pożądany efekt zostanie osiągnięty, a skutki uboczne mieszczą się w przewidywanym zakresie, wówczas lek zostanie pomyślnie zwalidowany (certyfikowany).
To samo dotyczy oprogramowania. Wykonawca wykonuje prace, przeprowadza weryfikację pod kątem zgodności funkcjonalności oprogramowania z zakresem zamówienia, ale klient instaluje oprogramowanie u siebie i sprawdza, czy spełnia powierzone mu zadanie, czy nie. Decyzja o walidacji lub przesłaniu do rewizji będzie również zależeć od wyników.
Innymi słowy... Weryfikacja jest potwierdzeniem wykonania zadania w pełnej zgodności z wymaganiami klienta. A walidacja to sprawdzenie, czy otrzymany produkt (produkt) działa tak, jak powinien w praktyce. Może zaistnieć sytuacja, gdy specyfikacja techniczna jest spełniona, ale produkt nie działa lub nie działa tak, jak powinien. Dlatego proces walidacji jest bardziej kompleksowy i orientacyjny niż weryfikacja (pieczęć „zwalidowana” jest umieszczana nad pieczęcią „zweryfikowany”, że tak powiem).
Walidacja i weryfikacja w serwisach internetowych online?
Najprawdopodobniej powyższe wyjaśnienia nie poruszyły Cię głęboko, ponieważ musiałeś poznać znaczenie tych słów z zupełnie innego powodu (poza ramami relacji klient-wykonawca). Niech zgadnę dlaczego?
Cóż, być może zaczepiłeś wirusa na swoim komputerze, a teraz wyskakujące okienko „Potwierdź weryfikację” nie pozwoli ci wejść do jakiejś sieci społecznościowej. Niejasno domyślasz się, że podanie numeru telefonu lub wysłanie SMS-a nie jest najlepszym rozwiązaniem problemu, dlatego na temat „co to jest walidacja”. Z góry powiem, że nie musisz niczego wysyłać, ale musisz wyczyścić komputer i przywrócić plik Host do pierwotnej postaci. Porozmawiamy o tym bardziej szczegółowo poniżej.
Możliwe jest również, że zarejestrowałeś się w jakimś systemie płatności (lub innym serwisie internetowym), gdzie oferta do weryfikacji Twoja karta płatnicza, uprawomocnić stronie internetowej lub zrób coś podobnego. Terminy burżuazyjne również nie wydawały się wam zbyt jasne.

W tym przypadku nie ma się czego obawiać. Na przykład podczas próby połączenia karty z kontem systemu płatności możesz zostać poproszony o weryfikację karty kredytowej (sprawdź ją pod kątem możliwości dokonywania płatności). Zwykle wypłacana jest z niego niewielka kwota, a następnie proszą o dokładne wskazanie, ile zostało wycofane. Jeśli wskazano, karta jest weryfikowana i będzie można ją wykorzystać do uzupełnienia lub wypłaty środków z wirtualnego konta.
Weryfikacja słowna jest tutaj używana zgodnie z jej przeznaczeniem, tj. jako synonim sprawdzania lub testowania. Ponieważ wiele usług w Runecie jest tworzonych na obraz i podobieństwo wcześniej stworzonych burżuazyjnych systemów płatniczych, terminologia jest często zapożyczana z tego miejsca. Ogólnie rzecz biorąc, tutaj możesz po prostu przetestować kartę pod kątem działania przed jej użyciem.
Niektóre usługi oferta przejścia przez procedurę walidacji, tj. poświadczenie (potwierdzenie) Twojego konta, aby uzyskać więcej opcji i uprawnień. Zazwyczaj wyraża się to w potwierdzeniu Twojej tożsamości (musisz wysłać skan paszportu; albo z ekranu komputera, na którym otwarta jest strona serwisu, albo podać numer telefonu, a następnie wpisać kod otrzymany SMS-em). Wszystko to jest dość często nazywane walidacją przez właścicieli usług, ponieważ słowo to stało się dość powszechne i stało się możliwe, aby powiedzieć „modne”.
Na przykład w Yandex Money musiałem przejść proces walidacji (identyfikacji), aby móc przyjmować płatności z niektórych usług do mojego portfela. Musiałem pokazać paszport i stać się swego rodzaju certyfikowanym użytkownikiem systemu. Wiele sieci społecznościowych prosi o podanie numeru telefonu komórkowego, a następnie przejście przez proces jego walidacji / weryfikacji (weryfikacji), wysyłając na niego SMS z kodem, który należy wprowadzić w specjalnym polu na stronie rejestracji.
Walidacja konta na Vkontatka i Odnoklassniki - masz wirusa
Ostatnio było ładnie wirus jest szeroko rozpowszechniony, który po wejściu na strony popularnych sieci społecznościowych (Vkontakte, Odnoklassniki, My World itp.) wyrzuca tabliczkę z komunikatem, że Twoje konto musi zostać zweryfikowane w opisany sposób.

Są oszustami. Bardzo dyskretnie i wymagająco wyciągną z ciebie pieniądze (płatne SMS-y itp.), sprawią, że zainstalujesz jakieś paskudne rzeczy na twoim komputerze lub zrobisz coś innego, niezbyt przyjemnego. Co robić?
Po pierwsze, nie daj się nabrać na te wszystkie sztuczki. Kto poprosił Cię o weryfikację - administrację sieci społecznościowej lub napastnik, który zmienił stronę sieci społecznościowej za pomocą wirusa? Jak sprawdzić? Dość proste.
- Spójrz na pasek adresu w przeglądarce, aby sprawdzić, czy jest tam zapisany adres sieci społecznościowej, a nie fałszywa witryna. Jeśli adres nie jest taki sam (jakaś litera została zastąpiona lub znaleziono inną), po prostu otwórz stronę sieci społecznościowej w nowej karcie z zakładek przeglądarki lub wpisując jej nazwę w Yandex (Google), a następnie klikając pierwszą podany link (będzie).
- Jeśli adres jest poprawny, spróbuj zalogować się na swoje konto Vkontakte lub Odnoklassniki z innego komputera (tabletu, telefonu komórkowego). Możesz także spróbować z tego samego komputera. Wszedłeś? Nie wymaga walidacji? Oznacza to, że Twój komputer jest zainfekowany wirusem i wymaga pilnego leczenia.
Po drugie, musisz zacząć szukać sposobu na usunięcie wirusa, a przynajmniej najpierw na zneutralizowanie jego konsekwencji. Jeśli Twój program antywirusowy nie jest tego wart lub nie jest aktywny (nie zapłaciłeś za kolejny okres, nie aktualizowałeś antywirusowej bazy danych, został zablokowany przez wirusa), spróbuj pobrać przenośna i darmowa wersja Doctor Web(Ufam mu od ponad dziesięciu lat) i po prostu przeprowadź szybką kontrolę.

Z pewnością powie, że zmieniłeś plik Hosts i zaoferujesz, że go naprawisz. Następnie, gdy wejdziesz w Kontakt, Odnoklassniki i inne sieci, nie będziesz już wymagał weryfikacji.
Jeśli to narzędzie z jakiegoś powodu ci nie pomogło (nie udało się pobrać, nie uruchomiło się itp.), Możesz spróbować samodzielnie znajdź i wyczyść z niepotrzebnych wpisów tzw Plik hostów.
Faktem jest, że wirus może napisać w nim linię z adresem sieci społecznościowej i zupełnie niepowiązanym adresem IP. Przeglądarka zawsze najpierw uzyskuje dostęp do pliku hosta na twoim komputerze (i dopiero potem w Internecie), a jeśli znajdzie dopasowanie między adresem IP a domeną (na przykład vk.com 109.121.92.15), otworzy portal społecznościowy z tego adresu IP, a tam już będzie przygotowana fałszywa strona podobna do dwóch kropli wody, podobna do prawdziwej, ale która przy próbie wejścia wyrzuci komunikat weryfikacyjny.
Jeśli żadne z powyższych nie pomogło, wypróbuj inne antywirusy lub możesz przywrócić salę operacyjną z obrazu, jeśli wcześniej zostało to zrobione, na przykład za pomocą Akronis. W najgorszym przypadku będziesz musiał albo zabrać komputer do specjalisty, albo samodzielnie zainstalować system Windows, a następnie zachować ostrożność i użyć programu antywirusowego, aby nie pojawiały się już tablice weryfikacyjne.
Powodzenia! Do zobaczenia wkrótce na stronach bloga
Możesz być zainteresowany
 Program edukacyjny - co to jest (znaczenie) VirusTotal - sprawdzanie wirusów online w komputerze, telefonie i plikach witryny jednocześnie ze wszystkimi programami antywirusowymi
Program edukacyjny - co to jest (znaczenie) VirusTotal - sprawdzanie wirusów online w komputerze, telefonie i plikach witryny jednocześnie ze wszystkimi programami antywirusowymi  Outsourcing - co to jest w prostych słowach
Outsourcing - co to jest w prostych słowach  Kontekst - co to jest? Homeopatia to lek nieszkodliwy lub szkodliwy dla zdrowia Czym jest życie - definicja i 4 główne etapy ludzkiego życia Jak zainstalować Google Chrome, Yandex Browser, Opera, Mazila i Internet Explorer za darmo na swoim komputerze? Sepsa – co to jest, skąd bierze się choroba, jakie są objawy i oznaki sepsy Lupus - czym jest ta choroba, jakie są jej objawy i rokowanie na skuteczne leczenie Czym jest tolerancja
Kontekst - co to jest? Homeopatia to lek nieszkodliwy lub szkodliwy dla zdrowia Czym jest życie - definicja i 4 główne etapy ludzkiego życia Jak zainstalować Google Chrome, Yandex Browser, Opera, Mazila i Internet Explorer za darmo na swoim komputerze? Sepsa – co to jest, skąd bierze się choroba, jakie są objawy i oznaki sepsy Lupus - czym jest ta choroba, jakie są jej objawy i rokowanie na skuteczne leczenie Czym jest tolerancja
MINISTERSTWO PRZEMYSŁU, NAUKI I TECHNIKI FEDERACJI ROSYJSKIEJ
INSTRUKCJE
PRODUKCJA WYROBÓW LECZNICZYCH.
WALIDACJA.
Postanowienia podstawowe
Moskwa - 2001
Przedmowa
1. OPRACOWANE przez Państwowe Przedsiębiorstwo Unitarne „Państwowy Instytut Projektowo-Badawczy Przemysłu Medycznego” (Państwowe Przedsiębiorstwo Unitarne „GiproNIImedprom”), Federalne Przedsiębiorstwo Unitarne „Państwowe Centrum Naukowe ds. Antybiotyków” (FSUE SSCA), NPF „CENTRUM POSTĘPU ”, Państwowa Akademia Chemiczno-Farmaceutyczna w Petersburgu (SP KhFA), z udziałem Laboratorium MEDFARMTEST.
WPROWADZONE przez Departament Restrukturyzacji i Rozwoju Przemysłu Biotechnologicznego i Medycznego Ministerstwa Przemysłu i Nauki Rosji.
2. ZAAKCEPTOWANE I WPROWADZONE ROZPORZĄDZENIEM Ministerstwa Przemysłu, Nauki i Technologii Federacji Rosyjskiej.
3. Niniejsze wytyczne wdrażają ogólne wymagania normy branżowej OST 42-510-98„Zasady organizacji produkcji i kontroli jakości leków (GMP)”.
4. WPROWADZONE PO RAZ PIERWSZY.
Zadowolony
Komisja Redakcyjna
Kukarin V.A., Topnikov I.V. (GUP „GiproNImedprom”), Shilova S.V. (GNTSA), Nefantiew O.E. (Państwowy Inspektorat Obiegu Leków), Meshkovsky A.P. (magazyn „Pharmateka”), Lyulina N.V. (Publiczna fundacja charytatywna wspierająca zdrowie „Zdrowie”), Fursov S.N. (Laboratorium OOO „MEDFARMTEST”), Pyatigorskaya N.V. (jednostkowe przedsiębiorstwo państwowe GNIIvitaminov)
Wstęp
Te wytyczne metodologiczne (MU) zostały opracowane w celu opracowania ogólnych wymagań normy branżowej OST 42-510-98 (GMP).
MU uwzględnia postanowienia najnowszych wydań krajowych dokumentów regulacyjnych, zalecenia Światowej Organizacji Zdrowia (WHO), Konwencji o Wzajemnym Uznawaniu Inspekcji Producenta Farmaceutycznego (PIC) oraz innych organizacji międzynarodowych.
Rozwój MU został przeprowadzony na zasadach przyjętych przez państwowy system normalizacji Federacji Rosyjskiej i z uwzględnieniem niezbędnej harmonizacji z międzynarodowymi normami w systemie zapewnienia jakości podczas projektowania, instalacji i produkcji.
Główne postanowienia tych MU są integralną częścią systemu zarządzania jakością w przedsiębiorstwie i mają na celu zapewnienie właściwej produkcji i kontroli jakości leków zgodnie z wymaganiami dokumentów regulacyjnych.
MU przewidują wzrost samodzielności i rozwój inicjatywy przedsiębiorstw i organizacji w rozwiązywaniu problemów organizacyjnych i technicznych związanych z realizacją podstawowych wymagań niniejszych wytycznych.
1 obszar zastosowania
MU są ogólnymi wytycznymi i ustanawiają podstawowe wymagania dotyczące organizacji i walidacji procesów oraz warunków wytwarzania produktów leczniczych.
Niniejsze wytyczne mają zastosowanie do przedsiębiorstw i organizacji, które, niezależnie od ich wydziałowego podporządkowania i formy własności, produkują jakiekolwiek produkty lecznicze.
MU dotyczą również produkcji sterylnych wyrobów medycznych (strzykawek, cewników itp.).
Ustawa federalna nr 86-FZ „O lekach” z dnia 22.06.98.
Norma branżowa OST 42-505-96 „Wyroby przemysłu medycznego. Przepisy technologiczne dotyczące produkcji. Treść, procedura opracowania, koordynacja i zatwierdzenie”.
Norma branżowa OST 42-510-98 „Zasady organizacji produkcji i kontroli jakości leków (GMP)”
3. Definicje
MU używa następujących terminów wraz z odpowiadającymi im definicjami
Walidacja - Udokumentowana procedura, która zapewnia wysoki stopień pewności, że określony proces, metoda lub system będą konsekwentnie generować wyniki spełniające z góry określone kryteria akceptacji.
Główny plan walidacji - Dokument opisujący filozofię, strategię i metodologię prowadzenia walidacji przedsiębiorstwa.
Protokół walidacji - Dokument odzwierciedlający wyniki walidacji procesu (PV) i kwalifikacji: dokumentacja projektowa (DQ), instalacja (IQ), eksploatacja (OQ) i eksploatacja (PQ) urządzeń, systemów inżynieryjnych, pomieszczeń czystych itp.
Produkt końcowy - Produkty, które przeszły wszystkie kolejne etapy procesu technologicznego, w tym pakowanie, etykietowanie, kontrolę jakości i są gotowe do sprzedaży.
Jakość - Zestaw właściwości i cech produktu, które wpływają na jego zdolność do zaspokojenia określonych potrzeb.
Kwalifikacja - Ocena i udokumentowane potwierdzenie, że dokumentacja projektowa, sprzęt, systemy inżynieryjne i inne warunki produkcji są w stanie osiągnąć oczekiwane i powtarzalne wyniki.
Kwalifikacja projektowa (DQ) - Ocena i udokumentowane potwierdzenie zgodności dokumentacji projektowej z wymaganiami zasad GMP.
Kwalifikacja instalacyjna (IQ) - Ocena i udokumentowane potwierdzenie zgodności jakości instalacji/instalacji urządzeń technologicznych i laboratoryjnych, instalacji inżynierskich, pomieszczeń „czystych” itp. z wymaganiami dokumentacji regulacyjnej i technicznej.
Kwalifikacja operacyjna (OQ) - Ocena i udokumentowane potwierdzenie zgodności wyposażenia technologicznego i laboratoryjnego, instalacji inżynierskich, wyposażonych pomieszczeń „czystych” itp. z wymaganiami dokumentacji regulacyjnej i technicznej.
Kwalifikacja wydajności (PQ) - Ocena i udokumentowane potwierdzenie zgodności niezawodności i sprawności parametrów eksploatacyjnych urządzeń technologicznych, eksploatacji systemów inżynierskich (pomieszczenia czyste, itp.), z wymaganiami dokumentacji regulacyjnej i technicznej.
Zanieczyszczenie - Zanieczyszczenie produktów podczas produkcji, pobierania próbek, pakowania, przechowywania lub transportu wewnętrznego.
Proces krytyczny (strefa, operacja, parametr itp.) - Proces (strefa, operacja, parametr itp.), który może spowodować zmianę jakości produktu pośredniego lub gotowego.
Leki - Substancje stosowane w profilaktyce, diagnostyce, leczeniu chorób, zapobieganiu ciąży; pozyskiwane z krwi, osocza krwi, a także narządów, tkanek ludzi lub zwierząt, roślin, mikroorganizmów, minerałów metodami syntezy lub przy użyciu technologii biologicznych. Do leków zalicza się również substancje pochodzenia roślinnego, zwierzęcego lub syntetycznego, które wykazują działanie farmakologiczne i są przeznaczone do wytwarzania leków.
Leki - Gotowe do użycia leki dawkowane.
"Najgorszy przypadek" - Warunki lub zestaw warunków związanych z górnymi i dolnymi parametrami procesu, które mogą prowadzić do wysokiego prawdopodobieństwa niezgodności w porównaniu z warunkami „idealnymi”.
Raport walidacyjny - Dokument przedsiębiorstwa odzwierciedlający i oceniający wyniki walidacji procesu (PV) i wszystkich etapów kwalifikacji (DQ, IQ, OQ, PQ).
Przedsiębiorstwo - producent leków (preparatów) - Organizacja zajmująca się produkcją leków (preparatów) zgodnie z wymogami ustawy federalnej „O lekach”.
Wiersz „Przedstawiciel” - Gama produktów o podobnych właściwościach do konkretnych celów.
Procedura - Uporządkowany zestaw działań, połączonych pewnymi relacjami, mających na celu rozwiązanie problemu.
Proces - Zbiór powiązanych ze sobą zasobów i działań, które przekształcają wkład w wyniki.
Proces pakowania - Wszystkie etapy i operacje technologiczne, w tym procesy napełniania i etykietowania, którym poddawane są produkty luzem, aby stać się wyrobami gotowymi.
Gotowe serie produktów - Pewna ilość gotowych produktów, uzyskana w warunkach gwarantujących ich jednolitość.
Standardowa procedura operacyjna. SPO (SPO) - Standardowa procedura operacyjna.
Specyfikacja - Dokument wyszczególniający wymagania, jakie muszą spełniać urządzenia, systemy inżynieryjne, pomieszczenia, produkty lub surowce i materiały używane lub otrzymywane w procesie produkcyjnym. Specyfikacja zawiera kryteria oceny jakości.
Proces technologiczny - Naukowo uzasadniony zestaw czynności wymaganych do uzyskania gotowego produktu. Składa się z oddzielnych, następujących po sobie etapów produkcji.
Czysty pokój - Pomieszczenie (pomieszczenie) specjalnie zaprojektowane, wybudowane i użytkowane, wyposażone w niezbędne systemy i urządzenia inżynieryjne, w którym stężenie zliczania cząstek aerozolu oraz stężenie żywych mikroorganizmów (CFU) w powietrzu utrzymywane jest w granicach nieprzekraczających określony, odpowiadający określonej klasie „czystości” i w którym inne parametry są monitorowane w razie potrzeby (np. temperatura, wilgotność względna, spadek ciśnienia).
Czysty pokój w dobrze wyposażonym stanie - Stan pomieszczenia czystego, w którym wszystkie systemy inżynieryjne i urządzenia technologiczne są sprawne, ale ich nie ma.
Funkcjonalny czysty pokój - Stan pomieszczenia czystego, w którym wszystkie systemy inżynieryjne i urządzenia technologiczne działają w trybach spełniających wymagania przepisów, w obecności wymaganej liczby personelu roboczego.
4. Postanowienia ogólne
4.1. Walidacja to część zasad GMP dotycząca niezawodności warunków produkcji i ich zdolności do osiągnięcia oczekiwanych rezultatów w zakresie jakości produktu. Walidacja jest ważną częścią systemu zapewniania i kontroli jakości.
Sama walidacja nie poprawia jakości produktu. Jego wyniki mogą zwiększać stopień zapewnienia jakości lub wskazywać na potrzebę poprawy warunków produkcji.
4.2. Organizacja pracy i odpowiedzialność są określone w sekcji 7 normy branżowej OST 42-510 (GMP).
4.4. Walidacji podlegają:
4.4.1. Procesy technologiczne.
4.4.2. Metody analityczne.
4.4.3. Procesy czyszczenia sprzętu, komunikacji itp.
4.4.4. Procesy dezynfekcji pomieszczeń itp.
4.4.5. Sprzęt technologiczny i laboratoryjny.
4.4.6. Systemy inżynieryjne, które bezpośrednio wpływają na jakość półproduktu i produktu gotowego (zaopatrzenie w czyste powietrze, wodę, parę, gaz obojętny, sprężone powietrze itp.).
4.4.7. Pomieszczenia i strefy „czyste”, pomieszczenia „zimne” itp.
4.5. Wyniki walidacji są dokumentowane w Raporcie z walidacji. Raport sporządzany jest odrębnie dla każdego konkretnego rodzaju produktu. Zalecana treść raportu jest podana w Załączniku A.
4.6. Nie podlega walidacji:
4.6.1. Sprzęt, który nie wpływa na jakość półfabrykatu i/lub gotowego produktu.
4.6.2. Systemy inżynieryjne, które nie wpływają bezpośrednio na jakość produktu, ale zapewniają trwałość procesu produkcyjnego (systemy zasilania, systemy zaopatrzenia w parę i wodę itp.).
4.6.3. Ogólne elementy konstrukcyjne budynków i pomieszczeń.
4.6.1. Pomocnicze systemy komputerowe niezwiązane bezpośrednio z procesem produkcyjnym.
4.7. Rodzaje walidacji:
4.7.1. Walidacja perspektywiczna. Przeprowadzany jest na nowo uruchomionej lub zrekonstruowanej produkcji przed jej uruchomieniem. Walidacja prospektywna wymaga wszystkich etapów kwalifikacji (DQ, IQ, OQ, PQ) oraz walidacji procesów i metod analitycznych.
4.7.2. Towarzysząca walidacja. Przeprowadza się ją podobnie jak prospektywnie podczas produkcji seryjnej, jeśli nie została wcześniej zwalidowana. Przy jednoczesnej walidacji wszystkie etapy kwalifikacji (DQ, IQ, OQ, PQ) oraz walidacja procesów i metod analitycznych są obowiązkowe.
4.7.3. Walidacja retrospektywna. Walidacja procesów i metod analitycznych przeprowadzana jest podczas seryjnej produkcji niesterylnych produktów leczniczych (jeśli nie została wcześniej walidowana) na podstawie analizy wcześniej uzyskanych udokumentowanych danych.
4.7.4. Rewalidacja (rewalidacja).
A) Przeprowadzana jest w sposób zaplanowany w terminie ustalonym przez przedsiębiorstwo w Raporcie Walidacyjnym.
B) Przeprowadza się ją przed wznowieniem produkcji w przypadku zmian w dokumentacji i/lub warunkach produkcji mogących mieć wpływ na jakość półproduktu i wyrobu gotowego Zakres prac walidacyjnych określa przedsiębiorstwo na podstawie zmiany dokonane.
4.8. Etapy walidacji:
4.8.1. Kwalifikacja.
4.8.2. Walidacja procesu (PV).
Zarys etapów walidacji znajduje się w Załączniku B.
4.9. Wyniki wszystkich etapów kwalifikacji (DQ, IQ, OQ, PQ) i walidacji procesu (PV) są dokumentowane (wymagane podczas pracy) protokołami walidacji. Zalecana zawartość protokołu jest podana w Załączniku B.
4.10. Kwalifikacja.
Wstępny etap walidacji, który jest przeprowadzany w celu sprawdzenia i oceny dokumentacji projektowej i warunków produkcji (sprzętu, systemów inżynieryjnych, pomieszczeń itp.) Pod kątem zgodności z wymaganiami dokumentacji regulacyjnej i technicznej.
Kwalifikacja odbywa się w określonej kolejności w następujących etapach:
4.10.1. Kwalifikacja projektowa (DQ). Dokumentacja jest sprawdzana i oceniana pod kątem zgodności z wymaganiami normy branżowej OST 42-510 (GMP).
4.10.2. Kwalifikacja instalacyjna (IQ). Sprawdzenie i ocena jakości instalacji/montażu urządzeń technologicznych i laboratoryjnych, systemów inżynierskich, (czystych (pomieszczenia itp.)
4.10.3. Kwalifikacja operacyjna (OQ). Sprawdzenie i ocena sprawności urządzeń technologicznych i laboratoryjnych, systemów inżynieryjnych, wyposażonych (czysto (pomieszczenia itp.)
4.10.4. Kwalifikacja wydajności (PQ). Weryfikacja i ocena niezawodności i sprawności parametrów eksploatacyjnych urządzeń technologicznych, systemów inżynierskich, funkcjonowania (czyste (pomieszczenia itp.)
Uwagi do punktów 4.10.3.-4.10.4.:
A) czasami prace kwalifikacyjne na etapach OQ i PQ mogą i powinny być prowadzone jednocześnie (np. dla „zimnych” pomieszczeń, inkubatorów, lodówek). W takim przypadku dozwolone jest sporządzenie wspólnego protokołu walidacji OQ/PQ;
B) kwalifikację wyposażenia technologicznego na etapie OQ można przeprowadzić z użyciem lub bez użycia symulatora leków;
C) kwalifikacja wyposażenia technologicznego na etapie PQ przeprowadzana jest przy użyciu symulowanego leku lub jednej partii rzeczywistego produktu (jeśli jest to konieczne i stosowne) w celu zakończenia kwalifikacji.
4.11. Walidacja procesu (PV).
Ostatni etap walidacji, który jest przeprowadzany po zakończeniu wszystkich etapów kwalifikacji warunków produkcji (sprzętu, systemów inżynieryjnych, pomieszczeń itp.), w zależności od rodzaju walidacji.
PV przeprowadza się osobno dla każdego procesu na próbkach co najmniej trzech partii rzeczywistego produktu.
4.12. Walidacji podlegają zarówno nowo tworzone (zrekonstruowane), jak i istniejące obiekty produkcyjne (zakłady produkcyjne, warsztaty itp.).
Ogólny schemat przeprowadzania walidacji w działającym zakładzie produkcyjnym przedstawiono w tabeli:
| Przedmiot walidacji Etap wstępny | Scena główna |
| Metody analityczne IQ i OQ Kwalifikacja sprzętu laboratoryjnego. | Walidacja metod farmakopealnych i niefarmakopealnych. |
| Procesy technologiczne Kwalifikacje na etapach IQ, OQ i PQ. | |
| Procesy pomocnicze (czyszczenie, odkażanie itp.) Walidacja skuteczności czyszczenia i innych procesów. | Walidacja każdego procesu (z wykonaniem protokołów walidacji PV). |
| Systemy inżynieryjne (zaopatrzenie w czyste powietrze, wodę, parę, gaz obojętny, sprężone powietrze itp.) W razie potrzeby kwalifikacja poszczególnych elementów systemu, w tym (np. obszary krytyczne, filtry) i podsystemy komputerowe. | Kwalifikacja systemu jako całość (IQ, OQ i PQ). |
| Pomieszczenia przemysłowe i laboratoryjne (pomieszczenia i strefy „czyste”, pomieszczenia „zimne” itp.) Kwalifikacja na etapach DQ i IQ. | Kwalifikacja pomieszczeń wyposażonych (protokoły OQ) i operacyjnych (protokoły PQ). |
4.13. Po walidacji przedsiębiorstwo produkcyjne musi sprawować kontrolę nad zmianami jako element systemu kontroli jakości w istniejącej produkcji.
5. Planowanie walidacji
5.1. Walidacja wymaga szczegółowego przygotowania i zaplanowania różnych etapów i etapów. Ponadto wszystkie prace muszą być wykonywane w określonej kolejności zgodnie z obowiązującymi dokumentami regulacyjnymi i technicznymi.
5.2. Charakterystyczną cechą prac walidacyjnych jest udział specjalistów z różnych działów przedsiębiorstwa oraz, w razie potrzeby, organizacji zewnętrznych i / lub ekspertów.
5.3. Do planowania walidacji wykorzystywana jest następująca dokumentacja:
5.3.1. Dokumentacja projektowa opracowana zgodnie z ustaloną procedurą.
5.3.2. Dokumentacja odbiorcza potwierdzająca zakończenie prac budowlanych, instalacyjnych i uruchomieniowych;
5.3.3. Przepisy, monografie, standardowe procedury operacyjne, instrukcje produkcji, specyfikacje i certyfikaty zgodności (sprzęt, surowce, materiały, konstrukcje, przyrządy pomiarowe itp.);
5.4. Obowiązkowym elementem planowania jest opracowanie formularzy protokołów walidacyjnych, raportów, metod.
Głównym dokumentem do planowania walidacji jest plan walidacji (VA).
5.4.1. Wymagania dotyczące sporządzenia IP i odpowiedzialności są określone w sekcji 7 normy branżowej OST 42-510 (GMP).
5.4.2. Każde przedsiębiorstwo określa sposób walidacji w oparciu o specyfikę produkcji. WP należy dostosować zgodnie z wynikami kontroli zmian w istniejącej produkcji.
5.4.3. Wiceprezes powinien zawierać ogólny opis prac walidacyjnych dotyczących warunków/parametrów krytycznych, ich struktury organizacyjnej (etapy, etapy) oraz harmonogram ich realizacji.
5.5. Wiceprezes umożliwia:
5.5.1. Kierownictwo przedsiębiorstwa powinno wiedzieć, co zawiera program walidacji, potrzebny na to czas i pieniądze, skład wykonawców oraz zaangażowane organizacje lub eksperci.
5.5.2. Członkowie zespołu walidacyjnego znają swoje zadania i obowiązki.
5.5.3. Inspektorzy GMP rozumieją podejście zakładu do walidacji, strukturę i organizację wszystkich prac walidacyjnych.
6. Kwalifikacja dokumentacji projektowej
(KWALIFIKACJA PROJEKTOWA - DQ)
6.1. W DQ dokumentacja jest sprawdzana i oceniana pod kątem zgodności z wymaganiami Industry Standard OST 42-510 (GMP) w zakresie:
6.1.1. Rozwiązania technologiczne i planistyczne.
6.1.2. Sprzęt, systemy inżynieryjne itp. podlegają walidacji.
6.1.3. Konstrukcje budowlane i materiały wykończeniowe do „czystych” pomieszczeń itp.
6.2. Do przeprowadzenia DQ wymagane są podstawowe dokumenty:
6.2.1. Odpowiednia licencja na prawo do wykonywania prac projektowych.
6.2.2. Uzgodnienie z odpowiednimi organizacjami inspekcyjnymi.
6.2.3. Niezbędne ekspertyzy.
7. Kwalifikacja instalacji
(KWALIFIKACJA INSTALACJI - IQ)
7.1. Za pomocą IQ ocenia się jakość instalacji/instalacji obiektu kwalifikacyjnego (sprzęt technologiczny i laboratoryjny, systemy inżynierskie, (czyste pomieszczenia itp.) poprzez oględziny i sprawdzenie dostępności niezbędnego zestawu dokumentacji.
7.2. Na etapie IQ sprawdzane są:
7.2.1. Dokumentacja (rysunki montażowe, specyfikacje, instrukcje obsługi i instrukcje bezpieczeństwa, dokumenty kalibracyjne/weryfikacyjne, wykaz elementów i części zamiennych, certyfikaty materiałów i wyrobów, protokoły i raporty z prób fabrycznych, opis systemu sterowania, SOP, dzienniki, dokumenty dotyczące czyszczenia, obróbki, sterylizacji itp.).
7.2.2. Ogólny układ/instalacja obiektu kwalifikacyjnego.
7.2.3. Systemy elektryczne i nieelektryczne.
7.2.4. Zgodność z warunkami bezpieczeństwa i wszelkimi szczegółowymi wymaganiami producenta środków.
W przypadku złożonego lub nieporęcznego sprzętu dozwolona jest inspekcja/odbiór w miejscu montażu dostawcy, ale nie zastępuje to etapu IQ w fabryce.
7.3. W przypadku niespełnienia kryteriów/wymagań IQ konieczne jest ustalenie dalszej procedury działań korygujących i terminu ich wdrożenia.
8. Kwalifikacja funkcjonalna
(KWALIFIKACJA OPERACYJNA - OQ)
8.1. OQ odbywa się po IQ. Funkcjonalność obiektu kwalifikacji jest sprawdzana i oceniana (wyposażenie technologiczne i laboratoryjne, wyposażone systemy inżynieryjne (pomieszczenia czyste itp.) poprzez testowanie funkcji i parametrów sprzętu / systemów przy użyciu, w razie potrzeby, przyrządów pomiarowych.
8.2. Faza OQ udoskonala standardowe procedury operacyjne, które zostały opracowane podczas fazy IQ.
8.3. OQ identyfikuje krytyczne warunki/parametry sprzętu/systemów. Na etapie OQ dozwolone jest, w razie potrzeby, użycie symulowanego produktu. Podczas badania parametrów krytycznych należy wziąć pod uwagę przypadki, w których wartości parametrów są równe górnym lub dolnym dopuszczalnym limitom podczas pracy. Jest to zwykle określane jako „najgorszy przypadek”.
8.4. Podczas walidacji/kwalifikacji wyposażonego (pomieszczenia czyste i strefy (produkcyjne i laboratoryjne) niezbędne parametry środowiska powietrza są mierzone i określane w sposób określony przez aktualne dokumenty regulacyjne. Na etapie OQ kontrola mikrobiologiczna środowiska powietrza (czyste pomieszczenia i strefy).
8.5. Na etapie OQ ważne jest udowodnienie, że wszystkie funkcje/parametry wydajności sterowania spełniają kryteria akceptacji, sprzęt/systemy działają poprawnie i niezawodnie w normalnych i najgorszych warunkach.
W przypadku złożonego lub nieporęcznego sprzętu dozwolona jest inspekcja/odbiór w miejscu montażu dostawcy, ale nie zastępuje to OQ na miejscu.
8.6. W przypadku niespełnienia kryteriów/wymagań IQ konieczne jest ustalenie dalszej procedury działań korygujących i terminu ich wdrożenia.
9. Kwalifikacja działania
(Kwalifikacja wydajności - PQ).
9.1. PQ wykonuje się po IQ i OQ. Wiarygodność i efektywność parametrów eksploatacyjnych obiektu kwalifikacji (urządzenia technologiczne, systemy inżynierskie działające (pokoje czyste itp.) są sprawdzane i oceniane poprzez badanie funkcji i parametrów sprzętu/systemów za pomocą symulatora leku lub próbek jednego partia rzeczywistego produktu, a także niezbędne przyrządy pomiarowe ...
9.2. Wskazane jest zakończenie kwalifikacji każdego elementu wyposażenia technologicznego etapem PQ w celu przystąpienia do walidacji procesu (PV), z następujących powodów:
9.2.1. Jeden sprzęt jest często używany do produkcji kilku rodzajów/nazw produktów.
9.2.2. W jednym procesie technologicznym z reguły stosuje się znaczną liczbę urządzeń różnych typów.
9.3. Etap PQ jest ostatnim etapem walidacji systemów inżynierskich (zapewnienie czystego powietrza, wody, pary, gazu obojętnego, sprężonego powietrza itp.), ponieważ każdy z nich wytwarza swój własny produkt końcowy (w tym przypadku Stopień PQ w odniesieniu do systemów, według zasadniczo identycznego z walidacją procesu (PV).
9.4. Przy walidacji/kwalifikacji funkcjonujących (czystych (produkcyjnych i laboratoryjnych) pomieszczeń) zgodności rzeczywistego stężenia żywych (tworzących kolonie) mikroorganizmów w 1 m3 powietrza z normami ustanowionymi przez Industry Standard OST 42-510 (GMP) dla pomieszczenia i strefy wszystkich klas czystości (A , B, C, D).
9.5. W przypadku niespełnienia kryteriów/wymagań PQ, przed rozpoczęciem walidacji procesu (PV) konieczne jest ustalenie przyczyn odchyleń i podjęcie działań w celu ich skorygowania (z udokumentowanymi dowodami).
10. Walidacja procesów
(Walidacja procesu - PV)
10.1. PV przeprowadza się po etapach kwalifikacji w zależności od rodzaju walidacji.
10.2. Walidacja procesów technologicznych przeprowadzana jest na próbkach co najmniej trzech partii rzeczywistego produktu w celu udowodnienia i udokumentowania, że proces (w założonych parametrach) ma powtarzalność i prowadzi do oczekiwanych rezultatów w produkcji półproduktu lub gotowy produkt o wymaganej jakości.
10.3. PV weryfikuje metody analityczne stosowane do kontroli procesów.
Walidacja metod analitycznych polega na określeniu: dokładności, odtwarzalności, czułości, stabilności (odtwarzalność międzylaboratoryjna), liniowości i innych cech metrologicznych. Walidacja metod analitycznych nie jest szczegółowo omawiana w niniejszym dokumencie.
10.4. Walidacja procesów pomocniczych (czyszczenie, sanityzacja itp.) przeprowadzana jest po walidacji metod analitycznych.
10.5. W przypadku negatywnych wyników uzyskanych na etapie PV, konieczne jest wyeliminowanie odchyleń przed rozpoczęciem produkcji wyrobu.
Załącznik A. Przykładowa zawartość raportu walidacyjnego
(Zalecana)
Raport walidacyjny zawiera następujące zapisy, informacje, dokumenty:
1. Przedmiot walidacji i jego identyfikacja, data (okres) i miejsce.
2. Cel i rodzaj walidacji.
3. Identyfikacja walidatorów (imię i nazwisko, stanowisko, podpis, data);
4. Informacje ogólne:
4.1. Ogólna charakterystyka obiektu, w tym parametry krytyczne.
4.2. Wykaz dokumentacji (przepisy, artykuły farmaceutyczne, dokumentacja projektowa, instrukcje, specyfikacje, certyfikaty, paszporty itp.).
4.3. Lista metod badawczych (pomiary, pobieranie próbek itp.) oraz kryteria oceny wyników.
4.4. Informacje o zaangażowanych organizacjach lub ekspertach.
5. Informacje o kalibracji/weryfikacji:
5.1. Przyrządy pomiarowe (przyrządy, czujniki, wagi itp.) zainstalowane w urządzeniach, systemach inżynierskich, pomieszczeniach itp.
5.2. Przyrządy pomiarowe stosowane w walidacji/kwalifikacji.
6. Dokumenty:
6.1. Protokoły walidacji wszystkich etapów kwalifikacji (DQ, IQ, OQ, PQ) i walidacji procesu (PV) lub link do nich ze wskazaniem miejsca przechowywania.
6.2. Protokoły (raporty itp.) z danymi i wynikami badań, pobierania próbek itp.
7. Analiza uzyskanych wyników, m.in. na:
7.1. Weryfikacja krytycznych warunków i parametrów.
7.2. Zidentyfikowane odchylenia (zmiany) wymagające działań naprawczych.
7.3. Warunki bezpieczeństwa i higieny pracy.
8. Wnioski z wyników walidacji.
9. Czas powtórnej zaplanowanej walidacji.
Dodatek B. Zarys kroków walidacji
(Informacyjne)

Notatka: Walidacja systemów komputerowych, jeśli to konieczne, odbywa się na różnych etapach z uwzględnieniem ich specyfiki. Niniejszy dokument nie obejmuje szczegółowo walidacji systemów komputerowych.
Protokoły z walidacji zawierają następujące postanowienia, informacje, dokumenty:
1. Przedmiot walidacji/kwalifikacji i jego identyfikacja, data (okres) i lokalizacja.
2. Rodzaj, etap i etap walidacji/kwalifikacji.
3. Identyfikacja walidatorów (imię i nazwisko, stanowisko, podpis, data), informacje o zaangażowanych organizacjach lub ekspertach.
4. Podział odpowiedzialności za sporządzenie, uzgodnienie, zatwierdzenie i przechowywanie protokołu.
5. Terminy i definicje.
6. Procedury i metody walidacji/kwalifikacji (w odniesieniu do obiektu).
7. Kryteria oceny warunków parametrów.
8. Dokumentacja normatywna (GOSTs, OSTs, regulaminy, MU itp.).
9. Informacje o wzorcowaniu/weryfikacji przyrządów pomiarowych wykorzystywanych podczas kwalifikacji i walidacji.
10. Informacje o wzorcowaniu/weryfikacji przyrządów pomiarowych (przyrządów, czujników itp.) zainstalowanych w urządzeniach, systemach inżynierskich, pomieszczeniach itp.;
11. Wyniki weryfikacji i oceny badań (testy, pomiary, pobieranie próbek itp.).
12. Zidentyfikowane odchylenia/zmiany i środki ich skorygowania.
14. Wnioski dotyczące wyników walidacji/kwalifikacji.
Notatka:
Zaleca się zamieszczenie krótkiej informacji na każdej stronie protokołu walidacji (nazwa przedsiębiorstwa, nazwa protokołu, etap/rodzaj/etap, kod, strona…od…)
1. Cele i zadania walidacji (polityka przedsiębiorstwa dotycząca prowadzenia walidacji).
2. Przypisanie odpowiedzialności za walidację/kwalifikację, pisanie i zatwierdzanie protokołów walidacji itp.
3. Terminy i definicje.
5. Struktura organizacyjna (scenariusz) walidacji, w tym:
5.1. Rodzaj, etapy i etapy walidacji/kwalifikacji.
5.2. Miejsce i czas pracy. Zaangażowane organizacje zewnętrzne i/lub eksperci.
5.3. Formy protokołów walidacji, raportów, tabel przestawnych itp.
5.4. Kalibracja / weryfikacja przyrządów pomiarowych.
5.5. Wykaz prac dotyczących walidacji procesów i kwalifikacji warunków produkcji (urządzenia technologiczne i laboratoryjne, systemy inżynierskie, pomieszczenia „czyste” itp.). Jednocześnie uzasadnione jest wyłączenie poszczególnych obiektów/procedury walidacji.
5.6. Wymagania dotyczące personelu, które należy wziąć pod uwagę podczas walidacji/kwalifikacji.
5.7. Warunki okresowego dostosowywania planu walidacji.
6. Opis przedsiębiorstwa, produkcji / lokalizacji, procesu, wyposażenia, systemów inżynieryjnych, produktu itp. (w tym podano linki do innych dokumentów).
7. Lista metod badawczych (pomiary, pobieranie próbek itp.). Kryteria oceny wyników, krytyczne warunki/parametry.
8. Zaleca się sporządzenie harmonogramu prac w formie tabeli ze wskazaniem nazwy przedmiotu walidacji/kwalifikacji, etapu/etapów, walidatorów odpowiedzialnych za koordynację/zatwierdzenie protokołów, czasu i miejsca, identyfikacji SOP, koszt itp.
9. Wymagane aplikacje (rysunki, schematy itp.).
Dodatek D. Bibliografia
(Informacyjne)
1. System Zarządzania Jakością ISO 9001: 2000. Wymagania.
2. Dobra praktyka wytwarzania leków. Kijów, „Morion” 1999.
3. Reglamentacja produkcji farmaceutycznej. Zapewnienie jakości produktu. Moskwa, "Remedium" 2001