Metody ochrony przed korozją metali. Metody ochrony przed korozją Do ochrony przed korozją użyj
Korozja - proces spontaniczny, a zatem postępujący ze spadkiem energii Gibbsa układu. Energia chemiczna reakcji korozyjnego niszczenia metali jest uwalniana w postaci ciepła i rozpraszana w otaczającej przestrzeni.
Korozja prowadzi do dużych strat w wyniku zniszczenia rurociągów, zbiorników, metalowych części maszyn, kadłubów statków, konstrukcji morskich itp. Nieodwracalne straty metali z korozji stanowią 15% ich rocznej produkcji. Celem zwalczania korozji jest ochrona zasobów metali, których na świecie brakuje. Badanie korozji i opracowanie metod ochrony przed nią metali jest przedmiotem zainteresowania teoretycznego i ma duże znaczenie gospodarcze dla kraju.
Rdzewienie żelaza w powietrzu, tworzenie się kamienia w wysokich temperaturach i rozpuszczanie metali w kwasach to typowe przykłady korozji. W wyniku korozji wiele właściwości metali ulega pogorszeniu: spada wytrzymałość i plastyczność, wzrasta tarcie między ruchomymi częściami maszyn, dochodzi do naruszenia wymiarów części. Rozróżnij korozję chemiczną i elektrochemiczną.
Chemiczna, korozja - niszczenie metali przez utlenianie w suchych gazach, w roztworach nieelektrolitów. Na przykład tworzenie się kamienia na żelazie w wysokich temperaturach. W tym przypadku warstewki tlenków utworzone na metalu często zapobiegają dalszemu utlenianiu, zapobiegając dalszemu przenikaniu zarówno gazów, jak i cieczy do powierzchni metalu.
Korozja elektrochemiczna nazywa się niszczeniem metali pod działaniem powstałych oparów galwanicznych w obecności wody lub innego elektrolitu. W tym przypadku, wraz z procesem chemicznym - uwalnianiem elektronów przez metale, zachodzi również proces elektryczny - przenoszenie elektronów z jednego obszaru do drugiego.
Ten rodzaj korozji dzieli się na odrębne typy: atmosferyczną, gruntową, korozję pod wpływem „wędrującego” prądu itp.
Korozja elektrochemiczna jest spowodowana zanieczyszczeniami zawartymi w metalu lub niejednorodnością jego powierzchni. W takich przypadkach, gdy metal wchodzi w kontakt z elektrolitem, który może być zaadsorbowany w powietrzu przez wilgoć, na jego powierzchni pojawia się wiele ogniw mikrogalwanicznych. ... Anody to cząsteczki metalu, katody - zanieczyszczenia i obszary metalu z bardziej dodatnim potencjałem elektrody. Anoda rozpuszcza się, a na katodzie uwalnia się wodór. Jednocześnie na katodzie możliwy jest proces redukcji tlenu rozpuszczonego w elektrolicie. W konsekwencji charakter procesu katodowego będzie zależał od pewnych warunków:
kwaśne środowisko: 2H + + 2ē \u003d H 2 (depolaryzacja wodoru),
О 2 + 4Н + + 4ē → 2Н 2 О
neutralne środowisko: O 2 + 2H 2 O + 4e - \u003d 4OH - (depolaryzacja tlenowa).
Jako przykład rozważmy korozja atmosferyczna żelazo w kontakcie z cyną. Interakcja metali z kroplą wody zawierającej tlen prowadzi do pojawienia się ogniwa mikrogalwanicznego, którego schemat ma postać
(-) Fe | Fe 2+ || O 2, H 2 O | Sn (+).
Bardziej aktywny metal (Fe) ulega utlenieniu, oddając elektrony atomom miedzi i przechodzi do roztworu w postaci jonów (Fe 2+). Na katodzie zachodzi depolaryzacja tlenu.
Metody ochrony przed korozją. Wszystkie metody ochrony przed korozją można z grubsza podzielić na dwie duże grupy: nieelektrochemiczne(metale stopowe, powłoki ochronne, zmiana właściwości środowiska korozyjnego, racjonalne projektowanie wyrobów) oraz elektrochemiczny (metoda projektowa, ochrona katodowa, ochrona anodowa).
Metale stopowe - To skuteczna, choć kosztowna metoda zwiększania odporności korozyjnej metali, w której do składu stopu wprowadza się składniki powodujące pasywację metalu. Jako takie komponenty stosuje się chrom, nikiel, tytan, wolfram itp.
Powłoki ochronne - są to warstwy sztucznie utworzone na powierzchni wyrobów i konstrukcji metalowych. Wybór rodzaju powłoki zależy od warunków, w jakich metal jest używany.
Materiały do metal powłokami ochronnymi mogą być czyste metale: cynk, kadm, aluminium, nikiel, miedź, cyna, chrom, srebro oraz ich stopy: brąz, mosiądz itp. Ze względu na charakter zachowania się powłok metalowych podczas korozji można je podzielić na katoda (na przykład na stali Cu, Ni, Ag) i anoda (cynk na stali). Powłoki katodowe mogą chronić metal przed korozją tylko w przypadku braku porów i uszkodzenia powłoki. W przypadku powłoki anodowej chroniony metal działa jak katoda, a zatem nie koroduje. Ale potencjały metali zależą od składu roztworów, dlatego wraz ze zmianą składu roztworu może również ulec zmianie charakter powłoki. Zatem powlekanie stali cyną w roztworze H 2 SO 4 jest katodowe, aw roztworze kwasów organicznych - anodowe.
Niemetaliczna ochrona powłoki mogą być zarówno nieorganiczne, jak i organiczne. Efekt ochronny takich powłok ogranicza się głównie do izolacji metalu od otoczenia.
Metoda ochrony elektrochemicznej oparty na zahamowaniu reakcji anodowych lub katodowych procesu korozji. Zabezpieczenie elektrochemiczne polega na połączeniu metalu o bardziej ujemnej wartości potencjału elektrody z chronioną konstrukcją (kadłub statku, rurociąg podziemny), która znajduje się w środowisku elektrolitowym (morze, woda gruntowa) - stąpać.
Korozja ma niszczący wpływ na produkty metalowe i stopy. Podczas interakcji z otoczeniem produkty metalowe ulegają poplamieniu w postaci rdzy. Im bardziej reaktywny metal, tym bardziej koroduje.
Korozja ma niszczący wpływ na samochody, statki, komunikację i inne produkty metalowe, co może prowadzić do wycieku ropy naftowej, gazu i innych negatywnych konsekwencji. Ma negatywny wpływ na zdrowie ludzi, a produkty utleniania zanieczyszczają środowisko.
Korozja jest niedopuszczalna w przemyśle lotniczym, chemicznym i jądrowym. Czasami koszt naprawy wyrobów metalowych przewyższa koszt materiału wydanego na ich produkcję.
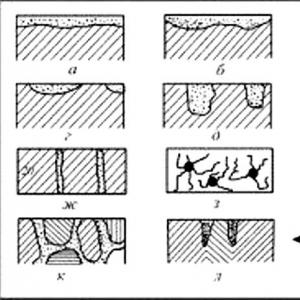
Główne rodzaje procesów korozyjnych
Rodzaje korozji metali można podzielić według następujących kryteriów: charakter zniszczenia, środowisko korozyjne i mechanizm działania.

W zależności od charakteru zniszczenia, korozja może być:
- solidny. Jednak może być jednolity i nierówny. Gdy produkt jest jednolity, cała powierzchnia produktu ulega zniszczeniu. Przy nierównościach pojawiają się plamy i kropkowane zagłębienia;
- międzykrystaliczny. W tym przypadku wnika głęboko w produkt wzdłuż granic ziaren metalu;
- transkrystaliczny, podczas gdy metal przecina się przez pęknięcie w ziarnie;
- selektywny. Jeden ze składników stopu ulega zniszczeniu. Na przykład cynk może rozkładać się w mosiądzu.
- podpowierzchniowo. Rozpoczyna się na powierzchni i stopniowo przenika do górnych warstw metalu.
Istnieją następujące rodzaje mediów korozyjnych:
- atmosfera;
- gleba;
- ciecz (roztwory zasad, kwasów lub soli).
Mechanizm działania dzieli korozję na chemiczną i elektrochemiczną.
Korozja chemiczna to proces, w którym następuje samorzutne niszczenie metali. Występuje, gdy wyroby metalowe oddziałują ze środowiskiem aktywnie korozyjnym, najczęściej gazowym. Procesom tym towarzyszą wysokie temperatury.

W rezultacie metal jest jednocześnie utleniany i zmniejsza się korozyjne środowisko. Korozja chemiczna występuje również podczas interakcji z cieczami organicznymi, na przykład produktami naftowymi, alkoholem itp.

W elektrolitach, takich jak roztwory wodne, występuje korozja elektrochemiczna. W wyniku reakcji elektrochemicznej powstaje prąd elektryczny, który rozkłada metal. W tym przypadku zachodzą zarówno procesy chemiczne, w których następuje uwolnienie elektronów, jak i elektryczne, w których poruszają się elektrony.
Zniszczenie następuje, gdy zetkną się różne metale. Dlatego metale są bardziej podatne na zniszczenie, w których występuje wiele zanieczyszczeń.
Niejednorodność konstrukcji metalowej prowadzi do tego, że podczas korozji elektrochemicznej pary katoda-anoda powstają zgodnie z prawami galwanizacji. Jeżeli produkty metalowe różnią się od siebie składem chemicznym, wówczas na powierzchni wyrobów metalowych tworzy się warstwa rdzy.
Ta korozja jest najczęściej przyczyną niszczenia metali. Poniżej zdjęcia przedstawiające mechanizm działania korozji elektrochemicznej.

W środowisku zewnętrznym tlen, wysoka wilgotność, tlenki siarki, azotu, dwutlenku węgla, wody gruntowe działają najaktywniej na produkty metalowe. Słona woda przyspiesza proces utleniania, dlatego statki morskie rdzewieją szybciej niż statki rzeczne.

Nie da się zatrzymać tego naturalnego procesu, pozostaje tylko znaleźć sposoby ochrony przed korozją. To prawda, że \u200b\u200bnie można całkowicie pozbyć się procesu korozji, ale metody te pomagają spowolnić sam proces.
Metody przeciwdziałania procesom korozyjnym
Istnieją następujące metody ochrony metali przed korozją:
- zwiększenie odporności metali poprzez zwiększenie składu chemicznego;
- izolacja powłok metalowych przed agresywnymi wpływami środowiska;
- zmniejszenie agresywności środowiska, w którym używane są wyroby metalowe;
- elektrochemiczne, które dzięki prawom galwanizacji ograniczają procesy korozyjne.
Metody te można podzielić na dwie duże grupy. Dwie pierwsze metody są stosowane przed użyciem wyrobów metalowych, czyli na etapie ich produkcji. Jednocześnie do produkcji produktu dobierane są określone materiały konstrukcyjne, nakładane są różne powłoki galwaniczne i ochronne.

Dwie ostatnie metody są stosowane w obróbce wyrobów metalowych. Jednocześnie w celu ochrony przez produkt przepuszczany jest prąd, agresywność środowiska jest redukowana poprzez dodawanie różnych inhibitorów, dzięki czemu sam produkt nie jest w żaden sposób wstępnie przetwarzany przed użyciem.
Metody zwiększania odporności
Te metody ochrony opierają się na tworzeniu stopów o właściwościach antykorozyjnych. Do metalu dodaje się składniki, aby zwiększyć jego odporność na korozję. Przykładem jest stopowanie stali z chromem.
Metodę stosuje się do produkcji stali. Rezultatem są chromowane stale nierdzewne, które są odporne na korozję. Zwiększają właściwości antykorozyjne stali poprzez dodanie niklu, miedzi i kobaltu.
Na tych powierzchniach nie pojawia się rdza, ale występuje korozja. Korozja ulega spowolnieniu w wyniku dodania jednego atomu domieszki do ośmiu atomów żelaza, a to reguluje ułożenie atomów w sieci krystalicznej roztworu stałego, co zapobiega korozji.

Odporność na korozję można poprawić, usuwając zanieczyszczenia z metali lub stopów, które przyspieszają korozję. Na przykład żelazo jest usuwane ze stopów magnezu lub aluminium, siarka ze stopów żelaza itp.
Zmniejszenie agresywności środowiska zewnętrznego i ochrona elektrochemiczna
Zmniejszenie agresywności środowiska zewnętrznego uzyskuje się poprzez usuwanie z niego substancji depolaryzujących lub izolowanie metali z depolaryzatora. Usuwanie tlenu z medium nazywa się odtlenianiem.

Aby spowolnić proces korozji, do środowiska wprowadzane są specjalne substancje - inhibitory. Mogą być zarówno organiczne, jak i nieorganiczne. Cząsteczki inhibitora są absorbowane przez powierzchnię metalu, a tym samym przyczyniają się do gwałtownego zmniejszenia szybkości rozpuszczania metalu i uniemożliwiają przebieg procesów elektrodowych.
Dzięki ochronie elektrochemicznej, wykorzystując zewnętrzny prąd elektryczny, który przepływa przez metal, potencjał metalu jest przesunięty, a tym samym zmienia się szybkość jego korozji.
W zależności od potencjalnego przesunięcia ochrona elektrochemiczna może być katodowa i anodowa. Metody te są wykorzystywane do ochrony platform wiertniczych, spawanych metalowych fundamentów, rurociągów przebiegających pod ziemią, a także do ochrony podwodnych części statków morskich.
Ochrona folii
W celu ochrony wyrobów metalowych przed korozją można nałożyć powłokę ochronną. Jako powłokę można użyć lakierów, farb, emalii, tworzyw sztucznych itp.

Farby i lakiery są łatwe do nakładania, niedrogie, mają właściwości hydrofobowe, nie wchodzą w reakcję chemiczną z metalem i dobrze wypełniają pory i pęknięcia. Służą do ochrony metali przed elementami środowiska, które powodują procesy korozyjne.
Jeśli wybierzesz odpowiednie farby i lakiery i zastosujesz się do technologii ich aplikacji, to mogą służyć jako powłoka nawet przez 5 lat.
Często pod lakier nakładany jest podkład, przez który woda rozpuszcza niektóre pigmenty i staje się mniej korozyjna. Zamiast podkładu powierzchnię można fosforanować. Nakłada się je pędzlem lub natryskiem. W przypadku wyrobów stalowych większość tych preparatów składa się z mieszanin fosforanów manganu i żelaza.

Możesz chronić produkt metalowy, nakładając warstwę metalu, która jest bardziej odporna na korozję. W takim przypadku korozja niszczy samą powłokę. Te metale to chrom, nikiel, cynk. Na przykład żelazo jest chromowane.
Opis
Korozja metalu reprezentuje jego zniszczenie w wyniku utleniania w procesach chemicznych lub elektrochemicznych. Najlepszym przykładem takiej korozji jest rdza. Istnieje jednak wiele rodzajów korozji metali.
Rodzaje korozji metali
Istnieje kilka klasyfikacji korozji metali. Tak więc, w zależności od rodzaju zniszczenia, rozróżnia się korozję ciągłą, lokalną i wżerową. Pierwsza wpływa równomiernie na całą powierzchnię metalu. Lokalna korozja powoduje powstawanie oddzielnych plam korozji. A korozja wżerowa wskazuje na początkowy etap uszkodzenia i objawia się w oddzielnych punktach zniszczenia.
Ze względu na charakter penetracji metalu można wyróżnić korozję międzykrystaliczną (międzykrystaliczną) i transkrystaliczną. Pierwsza wnika między ziarenkami metalu, wybierając najsłabsze punkty ich połączeń. Drugi przechodzi prosto przez ziarna metalu. Oba są niebezpieczne, ponieważ szybko prowadzą do pękania metalu i utraty wytrzymałości. W takim przypadku powierzchnia produktu może pozostać nienaruszona.
Osobno w tej klasyfikacji można wyróżnić korozję noża, która zwykle prowadzi do równego pęknięcia zlokalizowanego równolegle do spoiny. Z reguły występuje podczas używania produktów metalowych w agresywnych środowiskach.
Zgodnie z metodą interakcji metalu ze środowiskiem zwykle rozróżnia się korozja chemiczna i elektrochemiczna. metal... Pod względem chemicznym atomy metalu wiążą się z atomami działających na niego utleniaczy, które są częścią ośrodka. Z reguły dzieje się tak podczas interakcji z medium, które nie jest przewodnikiem elektryczności. Podczas korozji elektrochemicznej kationy sieci krystalicznej metalu wiążą się z innymi składnikami środowiska korozyjnego. W takim przypadku sam utleniacz otrzyma uwolnione elektrony. Ten rodzaj korozji jest typowy dla interakcji metali z roztworami lub stopionymi elektrolitami.
Można wyróżnić rodzaje korozji metali według rodzaju działającego na nią środowiska. Wyróżnia się więc korozję gazową, atmosferyczną, ciekłą i podziemną. Jednak najczęściej mówimy o mieszanych rodzajach korozji, kiedy na metal działa jednocześnie kilka mediów.
Metody ochrony metali przed korozją
Istnieje kilka podstawowych metod ochrony metalu przed korozją:
- zwiększenie składu chemicznego metalu w celu poprawy jego właściwości antykorozyjnych;
- izolacja powierzchni metalowej materiałami antykorozyjnymi;
- zmniejszenie agresywności środowiska, w którym produkowane i eksploatowane są wyroby metalowe;
- nałożenie zewnętrznego prądu, który zapewnia elektrochemiczną ochronę przed korozją.
W ten sposób możliwe jest zabezpieczenie wyrobów metalowych przed korozją przed lub w trakcie użytkowania.
Od dłuższego czasu zajmujemy się tym problemem ochrona metalu przed korozją i możemy zaoferować najlepsze opcje. Najprostszym z nich i szeroko stosowanym przez nas jest stosowanie specjalnych metalowych powłok ochronnych. Tym samym stosowanie powłok anodowych zwiększa się do maksymalnego ujemnego potencjału elektrochemicznego metalu, wykluczając możliwość korozji. Powłoka katodowa ma mniej wyraźny efekt i wymaga grubszej warstwy, ale jednocześnie znacznie zwiększa twardość i odporność produktu na zużycie.
Jeśli weźmiemy pod uwagę rodzaje powłok z punktu widzenia ich wytwarzania, to możemy wyróżnić osadzanie chemiczne i elektrolityczne, naparowywanie na gorąco i na zimno, natryskiwanie metali, napawanie i obróbkę termodyfuzyjną.
Jednym z najpopularniejszych sposobów ochrony metalu przed korozją jest stosowanie związków niemetalicznych. Może to być plastik, ceramika, guma, bitum, poliuretan, farby i lakiery i wiele innych. Co więcej, te ostatnie reprezentują najszerszy zakres i mogą być stosowane w zależności od warunków środowiskowych, w których produkt będzie używany. Tak wyróżnia się powłoki malarskie i lakiernicze odporne na działanie wody, atmosfery, roztworów chemicznych itp.
Aby złagodzić działanie ośrodka korozyjnego, można do niego wprowadzić niewielką ilość inhibitorów, które prowadzą do neutralizacji lub deoksygenacji ośrodka i tworzą warstwę adsorpcyjną, która chroni powierzchnię metalu. W takim przypadku folia może w pewnym stopniu zmienić parametry elektrochemiczne metali.
Elektrochemiczna ochrona metali przed korozją polega na polaryzacji katodowej lub anodowej (zewnętrzne działanie prądu). Można to również zrobić, mocując do produktu metalowego środki chroniące przed korozją.
We współczesnej produkcji dużą wagę przywiązuje się do opracowywania odpornych na korozję stopów metali. Na przykład odporność na korozję znacznie się poprawia, gdy do stopu żelaza dodaje się chrom i nikiel. Stopy magnezu do tego samego celu są stapiane z manganem, a stopy niklu z miedzią.
Nasza firma "Chermetkom" przywiązuje dużą wagę do problemu ochrony wyrobów metalowych przed korozją, nakładania specjalnych powłok, obróbki wyrobów metalowych prądem elektrycznym czy wykonywania zabezpieczeń ochronnych. Możesz również zakupić u nas produkty wykonane ze stopów odpornych na korozję. Ponadto metal i wyroby z niego można kupić w naszych magazynach w Moskwie lub zamówić wykonanie według indywidualnego projektu.
dodatkowo
Dodatkowa zakładka do zamieszczania informacji o sklepie, dostawie lub innych ważnych treściach. Pomoże Ci odpowiedzieć na pytania kupującego i rozwiać jego wątpliwości dotyczące zakupu. Używaj go według własnego uznania.
Możesz go usunąć lub zwrócić, zmieniając jedno pole wyboru w ustawieniach komponentu. Bardzo wygodnie.
Korozja to zniszczenie metalu, ceramiki, drewna i innych materiałów w wyniku oddziaływań chemicznych lub fizyko-chemicznych. Jeśli chodzi o przyczyny wystąpienia takiego niepożądanego efektu, są one różne. W większości przypadków jest to strukturalna niestabilność termodynamicznych skutków środowiska. Przyjrzyjmy się bliżej, czym jest korozja. Należy również wziąć pod uwagę rodzaje korozji, a mówienie o ochronie przed nią nie będzie zbyteczne.
Kilka informacji ogólnych
Przyzwyczailiśmy się do określenia „rdzewienie”, które jest używane w przypadku korozji metali i stopów. Istnieje też pojęcie „starzenia” - jest to charakterystyczne dla polimerów. Zasadniczo są tym samym. Uderzającym przykładem jest starzenie się wyrobów gumowych w wyniku aktywnej interakcji z tlenem. Dodatkowo pod wpływem działania dochodzi do zniszczenia niektórych elementów plastikowych, a szybkość korozji jest bezpośrednio zależna od warunków, w jakich obiekt się znajduje. Zatem rdza na produkcie metalowym będzie się rozprzestrzeniać, im szybciej, im wyższa będzie temperatura. Wilgotność ma również wpływ: im jest wyższa, tym szybciej staje się niezdatna do dalszego użytku. Zostało eksperymentalnie ustalone, że około 10 procent produktów metalowych jest nieodwracalnie odpisywanych, a winna jest korozja. Rodzaje korozji są różne i są klasyfikowane w zależności od rodzaju środowiska, charakteru przepływu i tym podobnych. Przyjrzyjmy się im bliżej.
Klasyfikacja
Obecnie istnieje ponad dwa tuziny rdzewiejących opcji. Przedstawimy tylko najbardziej podstawowe rodzaje korozji. Można je warunkowo podzielić na następujące grupy:
- Korozja chemiczna to proces interakcji ze środowiskiem korozyjnym, w którym redukcja utleniacza następuje w jednej czynności. Metal i utleniacz nie są rozdzielane przestrzennie.
- Korozja elektrochemiczna - proces interakcji metalu z jonizacją atomów i redukcją utleniacza przebiega w różny sposób, ale szybkość w dużej mierze zależy od potencjału elektrody.
- Korozja gazowa - chemiczne rdzewienie metalu przy minimalnej zawartości wilgoci (nie więcej niż 0,1%) i / lub wysokich temperaturach w środowisku gazowym. Najczęściej gatunek ten występuje w przemyśle chemicznym i rafineryjnym.

Ponadto istnieje wiele innych procesów rdzewienia. Wszystkie są korozją. Rodzaje korozji, oprócz opisanych powyżej, obejmują korozję biologiczną, radioaktywną, atmosferyczną, kontaktową, lokalną, docelową itp.
Korozja elektrochemiczna i jej cechy
W przypadku tego rodzaju zniszczenia proces zachodzi, gdy metal wchodzi w kontakt z elektrolitem. Tą ostatnią może być woda kondensacyjna lub woda deszczowa. Im więcej soli i kwasów jest zawartych w cieczy, tym wyższa przewodność elektryczna, a co za tym idzie, szybkość procesu. Jeśli chodzi o miejsca konstrukcji metalowej najbardziej podatne na korozję to są to nity, połączenia spawane, miejsca uszkodzeń mechanicznych. Jeśli właściwości strukturalne stopu żelaza sprawiają, że jest on odporny na rdzewienie, proces nieco zwalnia, ale i tak trwa. Doskonałym przykładem jest cynkowanie. Faktem jest, że cynk ma bardziej negatywny potencjał niż żelazo. Z tego prostego powodu stop żelaza ulega redukcji, a cynk koroduje. Jednak obecność warstwy tlenku na powierzchni znacznie spowalnia proces niszczenia. Oczywiście wszystkie rodzaje korozji elektrochemicznej są niezwykle niebezpieczne, a czasem wręcz niemożliwe do zwalczenia.

Korozja chemiczna
Ta zmiana w metalu jest dość powszechna. Uderzającym przykładem jest pojawienie się kamienia w wyniku interakcji produktów metalowych z tlenem. Wysoka temperatura działa w tym przypadku jako przyspieszacz procesu, a mogą w nim uczestniczyć płyny takie jak woda, sole, kwasy, zasady i roztwory soli. Jeśli mówimy o materiałach takich jak miedź czy cynk, to ich utlenianie prowadzi do powstania filmu odpornego na dalszą korozję. Produkty stalowe tworzą tlenki żelaza. Dalej prowadzi do pojawienia się rdzy, która nie zapewnia żadnej ochrony przed dalszym zniszczeniem, a wręcz przeciwnie, przyczynia się do tego. Obecnie wszystkie rodzaje korozji chemicznej są eliminowane przez cynkowanie. Można zastosować inne środki ochrony.

Rodzaje korozji betonu
Zmiany struktury i wzrost kruchości betonu pod wpływem środowiska mogą mieć trzy typy:
- Zniszczenie części kamienia cementowego jest jednym z najczęstszych rodzajów korozji. Występuje, gdy wyrób betonowy jest systematycznie narażony na opady atmosferyczne i inne płyny. W efekcie następuje wypłukanie hydratu tlenku wapnia i naruszenie struktury.
- Interakcja z kwasami. Jeśli kamień cementowy wejdzie w kontakt z kwasami, powstanie wodorowęglan wapnia - agresywny pierwiastek chemiczny dla produktu betonowego.
- Krystalizacja trudno rozpuszczalnych substancji. Zasadniczo jest to biokorozja. Najważniejsze jest to, że mikroorganizmy (zarodniki, grzyby) wchodzą do porów i rozwijają się tam, w wyniku czego następuje zniszczenie.

Korozja: rodzaje, metody ochrony
Miliardy dolarów strat rocznie doprowadziły ludzi do zmagania się z tymi szkodliwymi skutkami. Można śmiało powiedzieć, że wszystkie rodzaje korozji prowadzą do utraty nie samego metalu, ale cennych konstrukcji metalowych, na których budowę wydaje się dużo pieniędzy. Trudno powiedzieć, czy można zapewnić 100% ochronę. Jednak przy odpowiednim przygotowaniu powierzchni, które obejmuje obróbkę strumieniowo-ścierną, można osiągnąć dobre wyniki. Powłoka malarsko-lakiernicza niezawodnie chroni przed korozją elektrochemiczną, jeśli jest prawidłowo nałożona. Specjalna obróbka powierzchni niezawodnie chroni przed zniszczeniem metalu pod ziemią.
Aktywne i bierne metody walki
Istotą metod aktywnych jest zmiana struktury podwójnego pola elektrycznego. W tym celu stosuje się źródło prądu stałego. Napięcie należy dobrać w taki sposób, aby zwiększyć ochronę produktu. Inną niezwykle popularną metodą jest anoda protektorowa. Zapada się, chroniąc materiał podstawowy.

Ochrona bierna polega na zastosowaniu lakieru. Głównym zadaniem jest całkowite zapobieżenie przedostawaniu się wilgoci oraz tlenu do chronionej powierzchni. Jak wspomniano powyżej, sensowne jest stosowanie natryskiwania cynkiem, miedzią lub niklem. Nawet częściowo zniszczona warstwa ochroni metal przed rdzewieniem. Oczywiście tego typu zabezpieczenia antykorozyjne metalu są skuteczne tylko wtedy, gdy powierzchnia nie ma widocznych defektów w postaci pęknięć, odprysków itp.
Cynkowanie w szczegółach
Omówiliśmy już główne rodzaje korozji, a teraz chciałbym porozmawiać o najlepszych metodach ochrony. Jednym z nich jest cynkowanie. Jego istota polega na tym, że cynk lub jego stop jest nakładany na obrabianą powierzchnię, co nadaje powierzchni pewne właściwości fizyczne i chemiczne. Warto zaznaczyć, że metoda ta uważana jest za jedną z najbardziej ekonomicznych i efektywnych, i to pomimo faktu, że około 40 proc. Światowej produkcji tego pierwiastka przeznacza się na metalizację cynkową. Cynkowanie może być stosowane do blach stalowych, elementów złącznych, urządzeń i innych konstrukcji metalowych. Co ciekawe, powlekanie lub natryskiwanie metalu może chronić każdy rozmiar i kształt. Cynk nie ma funkcji dekoracyjnej, chociaż za pomocą specjalnych dodatków można uzyskać błyszczące powierzchnie. Zasadniczo ten metal jest w stanie zapewnić maksymalną ochronę w agresywnych środowiskach.
Wniosek

Więc powiedzieliśmy ci, czym jest korozja. Uwzględniono również rodzaje korozji. Teraz wiesz, jak chronić powierzchnię przed przedwczesną korozją. Ogólnie rzecz biorąc, jest to niezwykle proste, ale miejsce i sposób użycia produktu ma niemałe znaczenie. Jeśli jest stale poddawany obciążeniom dynamicznym i wibracyjnym, istnieje duże prawdopodobieństwo pęknięć powłok lakierniczych i lakierniczych, przez które wilgoć dostanie się do metalu, w wyniku czego będzie się stopniowo zapadał. Jednak użycie różnych uszczelek gumowych i uszczelniaczy w obszarach interakcji metali może nieznacznie przedłużyć żywotność powłoki.
Cóż, to wszystko w temacie. Pamiętaj, że przedwczesne uszkodzenie konstrukcji spowodowane korozją może mieć niezamierzone konsekwencje. W przedsiębiorstwie możliwe są duże szkody materialne i utrata życia w wyniku rdzewienia metalowej konstrukcji nośnej.
Głównym warunkiem ochrony antykorozyjnej metali i stopów jest zmniejszenie szybkości korozji. Istnieje możliwość zmniejszenia szybkości korozji poprzez zastosowanie różnych metod ochrony konstrukcji metalowych przed korozją. Najważniejsze z nich to:
1 Powłoki ochronne.
2 Leczenie środowiska korozyjnego w celu zmniejszenia korozyjności (szczególnie przy stałych ilościach środowisk korozyjnych).
3 Ochrona elektrochemiczna.
4 Rozwój i produkcja nowych materiałów konstrukcyjnych o podwyższonej odporności na korozję.
5 Przejście w wielu strukturach od metalu do materiałów odpornych chemicznie (wysokocząsteczkowe tworzywa sztuczne, szkło, ceramika itp.).
6 Racjonalne projektowanie i eksploatacja konstrukcji i części metalowych.
1. Powłoki ochronne
Powłoka ochronna musi być ciągła, równomiernie rozłożona na całej powierzchni, nieprzepuszczalna dla środowiska, mieć wysoką przyczepność (siłę przyczepności) do metalu, być twarda i odporna na ścieranie. Współczynnik rozszerzalności cieplnej powinien być zbliżony do współczynnika rozszerzalności cieplnej metalu chronionego przedmiotu.
Klasyfikację powłok ochronnych przedstawiono na rys. 43
Powłoki ochronne
Niemetaliczne powłoki metaliczne
InorganicOrganicCathodeAnode
Rysunek 43 - Schemat klasyfikacji powłok ochronnych
1.1 Powłoki metaliczne
Nakładanie ochronnych powłok metalowych jest jedną z najpowszechniejszych metod zwalczania korozji. Powłoki te nie tylko chronią przed korozją, ale także nadają ich powierzchni szereg cennych właściwości fizyko-mechanicznych: twardość, odporność na ścieranie, przewodnictwo elektryczne, lutowność, refleksyjność, zapewniają dekoracyjne wykończenie wyrobów itp.
Zgodnie z metodą działania ochronnego powłoki metalowe dzieli się na katodowe i anodowe.
Powłoki katodowe mają bardziej dodatnie i anodowe - bardziej elektroujemne potencjały elektrod w porównaniu z potencjałem metalu, na który są nakładane. Na przykład miedź, nikiel, srebro, złoto osadzone na stali są powłokami katodowymi, a cynk i kadm w stosunku do tej samej stali są powłokami anodowymi.
Należy zauważyć, że rodzaj powłoki zależy nie tylko od rodzaju metali, ale także od składu środowiska korozyjnego. Cyna w stosunku do żelaza w roztworach kwasów nieorganicznych i soli pełni rolę powłoki katodowej, aw szeregu kwasów organicznych (żywność konserwowa) pełni rolę anody. W normalnych warunkach powłoki katodowe chronią mechanicznie metal produktu, izolując go od środowiska. Głównym wymaganiem dla powłok katodowych jest porowatość. W przeciwnym razie, gdy produkt jest zanurzony w elektrolicie lub gdy na jego powierzchni skrapla się cienka warstwa wilgoci, odsłonięte (w porach lub pęknięciach) obszary metalu podstawowego stają się anodami, a powierzchnia powłoki staje się katodą. W miejscach nieciągłości rozpocznie się korozja metalu nieszlachetnego, która może rozprzestrzenić się pod powłoką (rys. 44 a).
Rysunek 11 Schemat korozji żelaza z porowatymi powłokami katodowymi (a) i anodowymi (b)
Powłoki anodowe chronią metal produktu nie tylko mechanicznie, ale głównie elektrochemicznie. W powstałym ogniwie galwanicznym metal powłoki staje się anodą i ulega korozji, a odsłonięte (w porach) obszary metalu nieszlachetnego działają jak katody i nie ulegają zniszczeniu, o ile utrzymywany jest kontakt elektryczny powłoki z chronionym metalem i przez system przepływa wystarczający prąd (rys. 4b). Dlatego stopień porowatości powłok anodowych, w przeciwieństwie do powłok katodowych, nie odgrywa znaczącej roli.
W niektórych przypadkach podczas nakładania powłok katodowych może mieć miejsce ochrona elektrochemiczna. Dzieje się tak, gdy metal powłoki jest skuteczną katodą w stosunku do przedmiotu obrabianego, a metal podstawowy ma tendencję do pasywacji. Powstała polaryzacja anodowa powoduje pasywację niezabezpieczonych (w porach) obszarów metalu nieszlachetnego i komplikuje ich zniszczenie. Ten rodzaj anodowej ochrony elektrochemicznej przejawia się w przypadku powłok miedzianych na stalach 12X13 i 12X18H9T w roztworach kwasu siarkowego.
Główną metodą nakładania ochronnych powłok metalowych jest galwanizacja. Stosuje się również metody termodyfuzyjne i mechanotermiczne, a także metalizację metodą natryskiwania i zanurzania w stopie.Przyjrzyjmy się bliżej każdej z metod.
1.2 Galwanizacja.
Galwaniczna metoda osadzania ochronnych powłok metalowych jest bardzo rozpowszechniona w przemyśle. W porównaniu z innymi metodami nakładania powłok metalowych ma szereg poważnych zalet: wysoką wydajność (ochronę metalu przed korozją zapewniają bardzo cienkie powłoki), możliwość uzyskania powłok z tego samego metalu o różnych właściwościach mechanicznych, łatwą kontrolę procesu (regulacja grubości i właściwości osadów metalu poprzez zmiany składu elektrolitu i reżimu elektrolizy), możliwość otrzymywania stopów o różnym składzie bez stosowania wysokich temperatur, dobra przyczepność do metalu podstawowego itp.
Wadą metody galwanicznej jest nierównomierność grubości powłoki na produktach o złożonym profilu.
Elektrochemiczne osadzanie metali odbywa się w kąpieli galwanicznej prądu stałego (Rysunek 45). Przedmiot pokryty metalem jest zawieszony na katodzie. Jako anody stosowane są płyty wykonane z osadzonego metalu (anody rozpuszczalne) lub z materiału nierozpuszczalnego w elektrolicie (anody nierozpuszczalne).
Istotnym składnikiem elektrolitu jest jon metalu, który osadza się na katodzie. W skład elektrolitu mogą też wchodzić substancje zwiększające jego przewodnictwo elektryczne, regulujące proces anodowy, zapewniające stałe pH, środki powierzchniowo czynne zwiększające polaryzację procesu katodowego, dodatki rozjaśniające i wyrównujące itp.
Rysunek 5 Kąpiel galwaniczna do elektroosadzania metali:
1 - skrzynka; 2 - obudowa wentylacyjna; 3 - nagrzewnica; 4 - izolatory; 5 - pręty anodowe; 6 - pręty katodowe; 7 - bełkot do mieszania ze sprężonym powietrzem
W zależności od postaci, w jakiej jon metalu wyładowczego znajduje się w roztworze, wszystkie elektrolity są podzielone na złożone i proste. Wyładowanie jonów złożonych na katodzie następuje przy wyższym przepięciu niż wyładowanie prostych jonów. Dlatego osady otrzymane ze złożonych elektrolitów są drobnoziarniste i mają jednorodną grubość. Jednak te elektrolity mają niższą sprawność prądową metalu i niższe gęstości prądu roboczego, tj. pod względem wydajności są gorsze od prostych elektrolitów, w których jon metalu występuje w postaci prostych jonów uwodnionych.
Rozkład prądu na powierzchni produktu w kąpieli galwanicznej nigdy nie jest równomierny. Prowadzi to do różnej szybkości osadzania, aw konsekwencji do grubości powłoki w poszczególnych odcinkach katody. Szczególnie silną zmianę grubości obserwuje się na produktach o złożonym profilu, co negatywnie wpływa na właściwości ochronne powłoki. Jednorodność grubości naniesionej powłoki poprawia się wraz ze wzrostem przewodnictwa elektrycznego elektrolitu, wzrostem polaryzacji wraz ze wzrostem gęstości prądu, spadkiem wydajności prądu metalu wraz ze wzrostem gęstości prądu oraz zwiększeniem odległości między katodą a anodą.
Zdolność kąpieli galwanicznej do wytwarzania równomiernie grubych powłok na reliefowej powierzchni nazywana jest zdolnością rozpraszania. Złożone elektrolity mają największą siłę rozpraszania.
W celu zabezpieczenia wyrobów przed korozją stosuje się galwaniczne osadzanie wielu metali: cynku, kadmu, niklu, chromu, cyny, ołowiu, złota, srebra itp. Stosuje się również stopy elektrolityczne np. Cu - Zn, Cu - Sn, Sn - Bi oraz powłoki wielowarstwowe.
Powłoki anodowe z cynkiem i kadmem najskuteczniej chronią metale żelazne (elektrochemicznie i mechanicznie) przed korozją.
Powłoki cynkowe służą do zabezpieczania części maszyn, rurociągów i blach stalowych przed korozją. Cynk to tani i łatwo dostępny metal. Chroni główny produkt metodami mechanicznymi i elektrochemicznymi, ponieważ w obecności porów lub nagich miejsc cynk ulega zniszczeniu, a stalowa podstawa nie koroduje.
Dominują powłoki cynkowe. Za pomocą cynku około 20% wszystkich części stalowych jest zabezpieczonych przed korozją, a około 50% cynku produkowanego na świecie jest wykorzystywane do galwanizacji.
W ostatnich latach opracowano prace nad tworzeniem ochronnych powłok galwanicznych ze stopów cynku: Zn - Ni (8 - 12% Ni), Zn - Fe, Zn - Co (0,6 - 0,8% Co). W takim przypadku można zwiększyć odporność powłoki na korozję 2-3 razy.