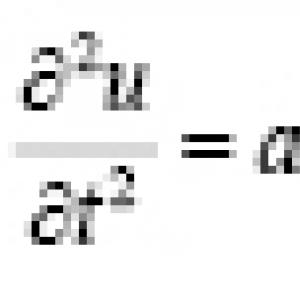Proprietățile cuprului pur ca metal: forjarea cuprului și aliajelor de cupru. Cuprul fără oxigen Care este ductilitatea cuprului
Oamenii au studiat proprietățile cuprului, care se găsește în natură sub formă de pepite destul de mari, încă din cele mai vechi timpuri, când vesela, armele, bijuterii și diverse produse de uz casnic erau fabricate din acest metal și aliajele sale. Utilizarea activă a acestui metal de mulți ani se datorează nu numai proprietăților sale speciale, ci și ușurinței procesării. Cuprul, care este prezent în minereu sub formă de carbonați și oxizi, se reduce destul de ușor, ceea ce strămoșii noștri străvechi au învățat să facă.
Inițial, procesul de recuperare a acestui metal părea foarte primitiv: minereul de cupru era pur și simplu încălzit la foc și apoi supus răcirii bruște, ceea ce a dus la crăparea bucăților de minereu, din care cuprul putea fi deja extras. Dezvoltarea ulterioară a acestei tehnologii a dus la faptul că aerul a început să fie suflat în foc: aceasta a crescut temperatura de încălzire a minereului. Apoi minereul a început să fie încălzit în structuri speciale, care au devenit primele prototipuri de cuptoare cu arbore.
Faptul că cuprul a fost folosit de omenire încă din cele mai vechi timpuri este dovedit de descoperiri arheologice, în urma cărora au fost găsite produse fabricate din acest metal. Istoricii au stabilit că primele produse din cupru au apărut deja în mileniul al X-lea î.Hr. și a început să fie extras, prelucrat și utilizat cel mai activ 8-10 mii de ani mai târziu. Desigur, premisele pentru o astfel de utilizare activă a acestui metal au fost nu numai ușurința relativă a extragerii sale din minereu, ci și proprietățile sale unice: greutate specifică, densitate, proprietăți magnetice, conductivitate electrică și specifică etc.
În zilele noastre, este deja dificil de găsit sub formă de pepite; de obicei este extras din minereu, care este împărțit în următoarele tipuri.
- Bornit - acest minereu poate conține cupru în cantități de până la 65%.
- Calcocit, numit și luciu de cupru. Un astfel de minereu poate conține până la 80% cupru.
- Pirita de cupru, numită și calcopirită (conținut de până la 30%).
- Covelline (conținut de până la 64%).

Cuprul poate fi extras și din multe alte minerale (malahit, cuprită etc.). Îl conțin în cantități diferite.
Proprietăți fizice
Cuprul în forma sa pură este un metal a cărui culoare poate varia de la roz la roșu.
Raza ionilor de cupru cu sarcină pozitivă poate lua următoarele valori:
- dacă indicele de coordonare corespunde cu 6 - până la 0,091 nm;
- dacă acest indicator corespunde la 2 - până la 0,06 nm.
Raza atomului de cupru este de 0,128 nm și este, de asemenea, caracterizat printr-o afinitate electronică de 1,8 eV. Când un atom este ionizat, această valoare poate lua o valoare de la 7,726 la 82,7 eV.
Cuprul este un metal de tranziție cu o valoare a electronegativității de 1,9 pe scara Pauling. În plus, starea sa de oxidare poate lua diferite valori. La temperaturi cuprinse între 20 și 100 de grade, conductivitatea sa termică este de 394 W/m*K. Conductivitatea electrică a cuprului, care este depășită doar de argint, este în intervalul 55,5-58 MS/m.
Deoarece cuprul din seria potențială este la dreapta hidrogenului, nu poate înlocui acest element din apă și diferiți acizi. Rețeaua sa cristalină are un tip cubic centrat pe față, valoarea sa este de 0,36150 nm. Cuprul se topește la o temperatură de 1083 de grade, iar punctul său de fierbere este de 26570. Proprietățile fizice ale cuprului sunt determinate și de densitatea sa, care este de 8,92 g/cm3.

Dintre proprietățile sale mecanice și indicatorii fizici, sunt de remarcat și următoarele:
- dilatare liniară termică - 0,00000017 unități;
- rezistența la tracțiune la care corespund produsele din cupru este de 22 kgf/mm2;
- duritatea cuprului pe scara Brinell corespunde unei valori de 35 kgf/mm2;
- greutate specifică 8,94 g/cm3;
- modulul elastic este de 132000 Mn/m2;
- valoarea alungirii este de 60%.
Proprietățile magnetice ale acestui metal, care este complet diamagnetic, pot fi considerate complet unice. Aceste proprietăți, împreună cu parametrii fizici: greutatea specifică, conductivitatea specifică și altele, explică pe deplin cererea largă pentru acest metal în producția de produse electrice. Aluminiul are proprietăți similare, care este, de asemenea, utilizat cu succes în producția de diverse produse electrice: fire, cabluri etc.
Partea principală a caracteristicilor pe care le are cuprul este aproape imposibil de schimbat, cu excepția rezistenței sale la tracțiune. Această proprietate poate fi îmbunătățită de aproape două ori (până la 420–450 MN/m2) dacă se efectuează o operație tehnologică precum călirea.
Proprietăți chimice
Proprietățile chimice ale cuprului sunt determinate de poziția sa în tabelul periodic, unde are numărul de serie 29 și este situat în a patra perioadă. Ceea ce este de remarcat este că se află în același grup cu metalele nobile. Acest lucru confirmă încă o dată unicitatea proprietăților sale chimice, care ar trebui să fie discutate mai detaliat.

În condiții de umiditate scăzută, cuprul nu prezintă practic nicio activitate chimică. Totul se schimbă dacă produsul este plasat în condiții caracterizate de umiditate ridicată și conținut ridicat de dioxid de carbon. În astfel de condiții, începe oxidarea activă a cuprului: pe suprafața sa se formează un film verzui format din CuCO3, Cu(OH)2 și diverși compuși cu sulf. Acest film, numit patina, îndeplinește funcția importantă de a proteja metalul împotriva distrugerii ulterioare.
Oxidarea începe să apară în mod activ atunci când produsul este încălzit. Dacă metalul este încălzit la o temperatură de 375 de grade, atunci se formează oxid de cupru pe suprafața sa, dacă este mai mare (375-1100 de grade), atunci scară cu două straturi.
Cuprul reacționează destul de ușor cu elementele care fac parte din grupul halogenului. Dacă un metal este plasat în vapori de sulf, acesta se va aprinde. De asemenea, prezintă un grad ridicat de afinitate pentru seleniu. Cuprul nu reacționează cu azotul, carbonul și hidrogenul chiar și la temperaturi ridicate.
Interacțiunea oxidului de cupru cu diferite substanțe merită atenție. Astfel, atunci când reacţionează cu acidul sulfuric, se formează sulfat şi cupru pur, cu acid bromhidric şi iodhidric – bromură şi iodură de cupru.
Reacțiile oxidului de cupru cu alcalii, care au ca rezultat formarea cupratului, arată diferit. Producția de cupru, în care metalul este redus la o stare liberă, se realizează folosind monoxid de carbon, amoniac, metan și alte materiale.
Cuprul, atunci când interacționează cu o soluție de săruri de fier, intră în soluție, iar fierul este redus. Această reacție este utilizată pentru a îndepărta stratul de cupru depus din diferite produse.
Cuprul mono și divalent este capabil să creeze compuși complecși care sunt foarte stabili. Astfel de compuși sunt săruri duble de cupru și amestecuri de amoniac. Ambele au găsit o aplicare largă în diverse industrii.

Aplicații ale cuprului
Utilizarea cuprului, precum și a aluminiului, care este cel mai asemănător ca proprietăți cu acesta, este bine cunoscută - în producția de produse prin cablu. Firele și cablurile de cupru se caracterizează prin rezistență electrică scăzută și proprietăți magnetice speciale. Pentru producția de produse prin cablu, se folosesc tipuri de cupru caracterizate prin puritate ridicată. Dacă în compoziția sa se adaugă chiar și o cantitate mică de impurități metalice străine, de exemplu, doar 0,02% aluminiu, atunci conductivitatea electrică a metalului original va scădea cu 8-10%.
Scăzut și rezistența sa ridicată, precum și capacitatea de a se preda diferitelor tipuri de prelucrare mecanică - acestea sunt proprietățile care fac posibilă producerea de țevi din aceasta care sunt utilizate cu succes pentru transportul de gaz, apă caldă și rece și abur. Nu este o coincidență că aceste conducte sunt utilizate ca parte a comunicațiilor inginerești ale clădirilor rezidențiale și administrative în majoritatea țărilor europene.
Cuprul, pe lângă conductivitatea electrică excepțional de ridicată, se distinge prin capacitatea sa de a conduce bine căldura. Datorită acestei proprietăți, este utilizat cu succes ca parte a următoarelor sisteme.
Putere. Rezistența este proprietatea solidelor care rezistă la distrugere, precum și la modificări ireversibile de formă. Principalul indicator al rezistenței este rezistența temporară, determinată la ruperea unei probe cilindrice care a fost recoacetă anterior. Pe baza rezistenței lor, metalele pot fi împărțite în următoarele grupuri:
fragil(rezistența temporară nu depășește 50 MPa) - staniu, plumb, bismut, precum și metale alcaline moi;
durabil(de la 50 la 500 MPa) - magneziu, aluminiu, cupru, fier, titan și alte metale care formează baza celor mai importante aliaje structurale;
putere mare(mai mult de 500 MPa) - molibden, wolfram, niobiu etc.
Conceptul de putere nu se aplică mercurului, deoarece este un lichid.
Rezistența la rupere a metalelor este indicată în tabelul 10.
Tabelul 10. Rezistența metalelor
Plastic. Plasticitatea este proprietatea solidelor de a reține o parte din deformarea lor atunci când sarcinile care le-au cauzat sunt îndepărtate. Ca indicator al ductilității, alungirea relativă este determinată selectiv prin aceleași încercări ca și rezistența la tracțiune.
În funcție de gradul de ductilitate, metalele sunt de obicei împărțite după cum urmează:
foarte plastic- (alungirea relativă depășește 40%) - metale care stau la baza majorității aliajelor structurale (aluminiu, cupru, fier, titan, plumb) și metale „ușoare” (sodiu, potasiu, rubidiu etc.);
plastic- (alungirea relativa variaza intre 3% si 40%) - magneziu, zinc, molibden, wolfram, bismut etc. (grupa cea mai extinsa);
fragil- (alungire relativă mai mică de 3%) - crom, mangan, colbat, antimoniu.
Purificarea ridicată a metalelor fragile crește ușor ductilitatea. Aliajele obținute din acestea sunt aproape imposibil de prelucrat sub presiune. Produsele industriale din acestea sunt adesea produse prin turnare. Alungirea relativă a metalelor este caracterizată în Tabelul 11.
Tabelul 11. Plasticitatea metalelor.
Duritate. Duritatea este o caracteristică a unui material care reflectă rezistența și ductilitatea acestuia, determinată prin indentarea unei bile (metoda Brinell) sau a unei prisme (metoda Vickers). O evaluare cantitativă a durității este numărul de duritate HB, egal cu raportul dintre sarcina (N) și aria suprafeței imprimării (mm 2). Valorile durității Brinell ale metalelor sunt date în tabelul 12.
Tabelul 12. Duritatea metalelor.
Modulul de elasticitate longitudinală. Modulul longitudinal de elasticitate, sau modulul lui Young, E determină lichidul metalului, adică. intensitatea creșterii tensiunii pe măsură ce elasticitatea deformației crește (Tabelul 13).
Tabelul 13. Modulul Young al metalelor la 20 o C.
- Denumire - Cu (Cupru);
- Perioada - IV;
- Grupa - 11 (Ib);
- Masa atomică - 63,546;
- Numărul atomic - 29;
- Raza atomică = 128 pm;
- Raza covalentă = 117 pm;
- Distribuția electronilor - 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 ;
- temperatura de topire = 1083,4°C;
- punct de fierbere = 2567°C;
- Electronegativitatea (după Pauling/după Alpred și Rochow) = 1,90/1,75;
- Stare de oxidare: +3, +2, +1, 0;
- Densitatea (nr.) = 8,92 g/cm3;
- Volumul molar = 7,1 cm 3 /mol.
Cuprul (cuprum, și-a primit numele în onoarea insulei Cipru, unde a fost descoperit un mare zăcământ de cupru) este unul dintre primele metale pe care omul le-a stăpânit - epoca cuprului (epoca în care uneltele de cupru predominau în uz uman) acoperă perioada. ale mileniului IV-III î.Hr. e.
Un aliaj de cupru și staniu (bronz) a fost obținut în Orientul Mijlociu 3000 î.Hr. e. Bronzul era preferat cuprului pentru că era mai puternic și mai ușor de forjat.

Orez. Structura atomului de cupru.
Configurația electronică a atomului de cupru este 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 (vezi Structura electronică a atomilor). În cupru, un electron pereche de la nivelul s exterior „sare” la subnivelul d al orbitalului exterior, care este asociat cu stabilitatea ridicată a nivelului d complet umplut. Subnivelul d stabil al cuprului determină inerția sa chimică relativă (cuprul nu reacționează cu hidrogenul, azotul, carbonul sau siliciul). Cuprul din compuși poate prezenta stări de oxidare +3, +2, +1 (cele mai stabile sunt +1 și +2).

Orez. Configurația electronică a cuprului.
Proprietățile fizice ale cuprului:
- metal, culoare roșu-roz;
- are maleabilitate și ductilitate ridicate;
- conductivitate electrică bună;
- rezistență electrică scăzută.
Proprietățile chimice ale cuprului
- Când este încălzit, reacţionează cu oxigenul:
O 2 + 2Cu = 2CuO; - atunci când este expus la aer pentru o perioadă lungă de timp, reacționează cu oxigenul chiar și la temperatura camerei:
O2 + 2Cu + CO2 + H20 = Cu(OH)2CuC03; - reacționează cu acidul azotic și acid sulfuric concentrat:
Cu + 2H2S04 = CuS04 + S02 + 2H20; - Cuprul nu reacționează cu apa, soluțiile alcaline, acidul clorhidric și acidul sulfuric diluat.
Conexiuni din cupru
Oxid de cupru CuO(II):
- un solid roșu-brun, insolubil în apă, prezintă proprietăți de bază;
- când este încălzit în prezența agenților reducători, dă cupru liber:
CuO + H2 = Cu + H20; - Oxidul de cupru este produs prin reacția cuprului cu oxigenul sau prin descompunerea hidroxidului de cupru (II):
O 2 + 2Cu = 2CuO; Cu(OH)2 = CuO + H2O.
Hidroxid de cupru Cu(OH 2)(II)):
- substanță cristalină sau amorfă de culoare albastră, insolubilă în apă;
- se descompune în apă și oxid de cupru atunci când este încălzit;
- reacționează cu acizii pentru a forma sărurile corespunzătoare:
Cu(OH2) + H2S04 = CuS04 + 2H20; - reacționează cu soluții alcaline, formând cuprați - compuși complecși de culoare albastru strălucitor:
Cu(OH2) + 2KOH = K2.
Pentru mai multe informații despre compușii de cupru, consultați Oxizii de cupru.
Producția și utilizarea cuprului
- Prin metoda pirometalurgică, cuprul este obținut din minereuri sulfurate la temperaturi ridicate:
CuFeS2 + O2 + Si02 → Cu + FeSi03 + SO2; - Oxidul de cupru este redus la cupru metal prin hidrogen, monoxid de carbon și metale active:
Cu20 + H2 = 2Cu + H20;
Cu2O + CO = 2Cu + CO2;
Cu2O + Mg = 2Cu + MgO.
Utilizarea cuprului este determinată de conductivitatea sa ridicată electrică și termică, precum și de ductilitate:
- producție de fire și cabluri electrice;
- în echipamente de schimb de căldură;
- în metalurgie pentru a produce aliaje: bronz, alamă, cupronic;
- în electronica radio.
Cuprul este unul dintre primele metale pe care omul a început să le folosească în scopuri tehnice. Împreună cu aurul, argintul, fierul, staniul, plumbul și mercurul, cuprul este cunoscut oamenilor din cele mai vechi timpuri și își păstrează importanța sa tehnică până astăzi.
Cupru sau Cu(29)
Cuprul este un metal roz-roșu, aparține grupului de metale grele și este un excelent conductor de căldură și curent electric. Conductivitatea electrică a cuprului este de 1,7 ori mai mare decât cea a aluminiului și de 6 ori mai mare decât cea a fierului.
Numele latin pentru Cuprum de cupru provine de la numele insulei Cipru, unde deja în secolul al III-lea. î.Hr e. Erau mine de cupru și cuprul era topit. Pe la secolul al II-lea - al III-lea. Topirea cuprului a fost efectuată pe scară largă în Egipt, Mesopotamia, Caucaz și alte țări ale lumii antice. Dar, cu toate acestea, cuprul este departe de cel mai comun element din natură: conținutul de cupru din scoarța terestră este de 0,01%, iar acesta este doar locul 23 dintre toate elementele găsite.
Producția de cupru
În natură, cuprul este prezent sub formă de compuși ai sulfului, oxizi, hidrocarbonați, compuși de dioxid de carbon, ca parte a minereurilor sulfurate și a metalului de cupru nativ.
Cele mai comune minereuri sunt pirita de cupru și luciul de cupru, care conțin 1-2% cupru.
90% din cuprul primar se obține prin metoda pirometalurgică, 10% - prin metoda hidrometalurgică. Metoda hidrometalurgică este producerea cuprului prin levigarea acestuia cu o soluție slabă de acid sulfuric și separarea ulterioară a cuprului metalic din soluție. Metoda pirometalurgică constă în mai multe etape: îmbogățire, prăjire, topire pentru mată, purjare în convertor, rafinare.
Pentru îmbogățirea minereurilor de cupru se folosește metoda de flotație (bazată pe utilizarea diferitelor umectare a particulelor care conțin cupru și a rocii reziduale), care permite obținerea unui concentrat de cupru care conține de la 10 la 35% cupru.
Minereurile de cupru și concentratele cu conținut ridicat de sulf sunt supuse prăjirii oxidative. În procesul de încălzire a concentratului sau minereului la 700-800°C în prezența oxigenului atmosferic, sulfurile sunt oxidate, iar conținutul de sulf este redus cu aproape jumătate față de cel original. Se ard numai concentratele sărace (cu un conținut de cupru de la 8 la 25%), iar concentratele bogate (de la 25 la 35% cupru) sunt topite fără ardere.
După prăjire, minereul și concentratul de cupru sunt topite în mată, care este un aliaj care conține sulfuri de cupru și fier. Mate conține de la 30 la 50% cupru, 20-40% fier, 22-25% sulf, în plus, mata conține impurități de nichel, zinc, plumb, aur și argint. Cel mai adesea, topirea se realizează în cuptoare cu reverberație de foc. Temperatura în zona de topire este de 1450°C.
Pentru a oxida sulfurile și fierul, mata de cupru rezultată este supusă suflarii cu aer comprimat în convertoare orizontale cu suflare laterală. Oxizii rezultați sunt transformați în zgură. Temperatura din convertor este de 1200-1300°C. Interesant este că căldura este eliberată în convertor din cauza reacțiilor chimice, fără alimentare cu combustibil. Astfel, convertizorul produce cupru blister care conține 98,4 - 99,4% cupru, 0,01 - 0,04% fier, 0,02 - 0,1% sulf și o cantitate mică de nichel, staniu, antimoniu, argint, aur. Acest cupru este turnat într-o oală și turnat în matrițe de oțel sau într-o mașină de turnare.
În continuare, pentru a îndepărta impuritățile dăunătoare, cuprul blister este rafinat (se efectuează rafinarea la foc și apoi rafinarea electrolitică). Esența rafinării la foc a cuprului blister este oxidarea impurităților, îndepărtarea lor cu gaze și transformarea lor în zgură. După rafinarea la foc se obține cuprul cu o puritate de 99,0 - 99,7%. Se toarnă în matrițe și se obțin lingouri pentru topirea ulterioară a aliajelor (bronz și alamă) sau lingouri pentru rafinarea electrolitică.
Rafinarea electrolitică se realizează pentru a obține cupru pur (99,95%). Electroliza se realizează în băi în care anodul este realizat din cupru rafinat la foc, iar catodul este realizat din foi subțiri de cupru pur. Electrolitul este o soluție apoasă. Când trece un curent continuu, anodul se dizolvă, cuprul intră în soluție și, curățat de impurități, se depune pe catozi. Impuritățile se depun pe fundul băii sub formă de zgură, care este prelucrată pentru a extrage metale valoroase. Catozii se descarcă după 5-12 zile, când greutatea lor ajunge la 60 până la 90 kg. Sunt spălate temeinic și apoi topite în cuptoare electrice.
În plus, există tehnologii pentru obținerea cuprului din fier vechi. În special, cuprul rafinat este obținut din deșeuri prin rafinare la foc.
În funcție de puritate, cuprul este împărțit în grade: M0 (99,95% Cu), M1 (99,9%), M2 (99,7%), M3 (99,5%), M4 (99%).
Proprietățile chimice ale cuprului
Cuprul este un metal slab activ care nu interacționează cu apa, soluțiile alcaline, acidul clorhidric și acidul sulfuric diluat. Totuși, cuprul se dizolvă în agenți oxidanți puternici (de exemplu, azot și sulf concentrat).
Cuprul are o rezistență destul de mare la coroziune. Cu toate acestea, într-o atmosferă umedă care conține dioxid de carbon, suprafața metalului devine acoperită cu o acoperire verzuie (patină).
Proprietățile fizice de bază ale cuprului
Proprietățile mecanice ale cuprului
La temperaturi negative, cuprul are proprietăți de rezistență mai mare și o ductilitate mai mare decât la o temperatură de 20°C. Cuprul comercial nu are semne de fragilitate la rece. Pe măsură ce temperatura scade, limita de curgere a cuprului crește, iar rezistența la deformarea plastică crește brusc.
Aplicații de cupru
Proprietățile cuprului, cum ar fi conductivitatea electrică și conductibilitatea termică, au determinat principala zonă de aplicare a cuprului - industria electrică, în special pentru fabricarea de fire, electrozi etc. Metalul pur (99,98-99,999%) este utilizat pentru aceasta. scop.supus rafinarii electrolitice.
Cuprul are numeroase proprietăți unice: rezistență la coroziune, fabricabilitate bună, o durată de viață destul de lungă și se potrivește bine cu lemnul, piatra naturală, cărămidă și sticlă. Datorită proprietăților sale unice, acest metal a fost folosit în construcții încă din cele mai vechi timpuri: pentru acoperișuri, decorarea fațadelor clădirilor etc. Durata de viață a structurilor din cupru este de sute de ani. În plus, părțile echipamentelor chimice și uneltele pentru lucrul cu substanțe explozive sau inflamabile sunt fabricate din cupru.
O aplicație foarte importantă a cuprului este producția de aliaje. Unul dintre cele mai utile și mai frecvent utilizate aliaje este alama (sau cuprul galben). Principalele sale componente sunt cuprul și zincul. Adăugările de alte elemente fac posibilă obținerea alamei cu o mare varietate de proprietăți. Alama este mai dura decât cuprul, maleabilă și rezistentă, așa că poate fi rulată cu ușurință în foi subțiri sau ștanțată într-o mare varietate de forme. O problemă: devine negru în timp.
Bronzul este cunoscut din cele mai vechi timpuri. Este interesant că bronzul este mai fuzibil decât cuprul, dar duritatea sa este superioară cuprului și staniului pur individual. Dacă acum 30-40 de ani doar aliajele de cupru și staniu se numeau bronz, astăzi sunt deja cunoscute bronzurile de aluminiu, plumb, siliciu, mangan, beriliu, cadmiu, crom și zirconiu.
Aliajele de cupru, precum și cuprul pur, au fost folosite de mult timp pentru producerea diverselor unelte, ustensile și sunt folosite în arhitectură și artă.
Monedele de cupru și statuile de bronz au decorat casele oamenilor din cele mai vechi timpuri. Produsele din bronz de la maeștrii Egiptului Antic, Greciei și Chinei au supraviețuit până în zilele noastre. Japonezii au fost mari maeștri în domeniul turnării bronzului. Figura uriașă a lui Buddha de la Templul Todaiji, creată în secolul al VIII-lea, cântărește mai mult de 400 de tone. Pentru a turna o astfel de statuie a fost nevoie de o abilitate cu adevărat remarcabilă.
Printre mărfurile pe care comercianții din Alexandria le comercializau în antichitate, „verdele de cupru” erau foarte populare. Fashioniștii foloseau această vopsea pentru a adăuga cercuri verzi sub ochi - în acele zile era considerată un semn de bun gust.
Din cele mai vechi timpuri, oamenii au crezut în proprietățile miraculoase ale cuprului și au folosit acest metal pentru a trata multe afecțiuni. Se credea că o brățară de cupru purtată pe o mână ar aduce noroc și sănătate proprietarului ei, ar normaliza tensiunea arterială și ar preveni depunerea de sare.
Multe popoare încă atribuie proprietăți vindecătoare cuprului. Locuitorii din Nepal, de exemplu, consideră cuprul un metal sacru care promovează concentrarea gândurilor, îmbunătățește digestia și tratează bolile gastrointestinale (pacienților li se oferă apă de băut dintr-un pahar care conține mai multe monede de cupru). Unul dintre cele mai mari și mai frumoase temple din Nepal se numește „Cupru”.
A existat un caz când minereul de cupru a devenit... vinovatul accidentului pe care l-a suferit cargoul norvegian Anatina. Calele navei, care se îndreptau spre țărmurile Japoniei, erau umplute cu concentrat de cupru. Deodată a sunat o alarmă: nava avusese o scurgere.
S-a dovedit că cuprul conținut în concentrat a format un cuplu galvanic cu corpul de oțel al Anatinei, iar evaporarea apei de mare a servit drept electrolit. Curentul galvanic rezultat a corodat corpul navei într-o asemenea măsură încât au apărut găuri în ea, în care s-a turnat apa oceanului.
Cuprul este un metal ductil roz-auriu cu un luciu metalic caracteristic. În sistemul periodic al lui D.I. Mendeleev, acest element chimic este denumit Cu (Cuprum) și este situat sub numărul de serie 29 în grupul I (subgrup lateral), în perioada a 4-a.
Numele latin Cuprum provine de la numele insulei Cipru. Sunt cunoscute fapte că în Cipru încă din secolul al III-lea î.Hr. existau mine de cupru și meșteri locali topeau cuprul. Puteți cumpăra cupru de la companie « ».
Potrivit istoricilor, societatea este familiarizată cu cuprul de aproximativ nouă mii de ani. Cele mai vechi produse din cupru au fost găsite în timpul săpăturilor arheologice din zona Turciei moderne. Arheologii au descoperit mărgele mici de cupru și farfurii folosite pentru a decora îmbrăcămintea. Descoperirile datează de la începutul mileniului VIII-7 î.Hr. În antichitate, cuprul era folosit pentru a face bijuterii, vase scumpe și diverse unelte cu lame subțiri.
O mare realizare a metalurgiștilor antici poate fi numită producția unui aliaj cu o bază de cupru - bronz.
Proprietățile de bază ale cuprului
1. Proprietăți fizice.
În aer, cuprul capătă o nuanță roșu-gălbuie strălucitoare datorită formării unei pelicule de oxid. Plăcile subțiri au o culoare verzuie-albastru atunci când sunt examinate prin ele. În forma sa pură, cuprul este destul de moale, maleabil și ușor de rulat și tras. Impuritățile îi pot crește duritatea.
Conductivitatea electrică ridicată a cuprului poate fi numită principala proprietate care determină utilizarea sa predominantă. De asemenea, cuprul are o conductivitate termică foarte mare. Impuritățile precum fierul, fosforul, staniul, antimoniul și arsenul afectează proprietățile de bază și reduc conductivitatea electrică și termică. Conform acestor indicatori, cuprul este al doilea după argint.
Cuprul are densități mari, puncte de topire și puncte de fierbere. O proprietate importantă este, de asemenea, rezistența bună la coroziune. De exemplu, la umiditate ridicată, fierul se oxidează mult mai repede.
Cuprul se pretează bine la prelucrare: rulat în foi de cupru și tijă de cupru, tras în sârmă de cupru cu o grosime adusă la miimi de milimetru. Acest metal este diamagnetic, adică este magnetizat împotriva direcției câmpului magnetic extern.

Cuprul este un metal relativ slab activ. În condiții normale în aer uscat, oxidarea acestuia nu are loc. Reacționează ușor cu halogeni, seleniu și sulf. Acizii fără proprietăți oxidante nu au niciun efect asupra cuprului. Nu există reacții chimice cu hidrogenul, carbonul și azotul. În aerul umed, oxidarea are loc pentru a forma carbonat de cupru (II) - stratul superior de platină.
Cuprul este amfoter, adică formează cationi și anioni în scoarța terestră. În funcție de condiții, compușii de cupru prezintă proprietăți acide sau bazice.

Metode de obținere a cuprului
În natură, cuprul există în compuși și sub formă de pepite. Compușii sunt reprezentați de oxizi, bicarbonați, complexe de sulf și dioxid de carbon, precum și minereuri sulfurate. Cele mai comune minereuri sunt pirita de cupru și luciul de cupru. Conținutul de cupru din ele este de 1-2%. 90% din cuprul primar este extras prin metoda pirometalurgică și 10% prin metoda hidrometalurgică.
1.
Metoda pirometalurgică include următoarele procese: îmbogățire și prăjire, topire pentru mată, purjare în convertor, rafinare electrolitică.
Minereurile de cupru sunt îmbogățite prin flotație și prăjirea oxidativă. Esența metodei de flotație este următoarea: particulele de cupru suspendate într-un mediu apos aderă la suprafața bulelor de aer și se ridică la suprafață. Metoda vă permite să obțineți concentrat de pulbere de cupru, care conține 10-35% cupru.
Minereurile și concentratele de cupru cu un conținut semnificativ de sulf sunt supuse prăjirii oxidative. Când sunt încălzite în prezența oxigenului, sulfurile sunt oxidate, iar cantitatea de sulf este redusă la aproape jumătate. Se prăjesc concentratele sărace care conțin 8-25% cupru. Concentratele bogate care conțin 25-35% cupru sunt topite fără a se recurge la prăjire.
Următoarea etapă a metodei pirometalurgice de producere a cuprului este topirea pentru mată. Dacă ca materie primă se folosește minereu de cupru cu o cantitate mare de sulf, atunci topirea se realizează în cuptoare cu arbore. Iar pentru concentratul de flotație sub formă de pulbere se folosesc cuptoare cu reverberație. Topirea are loc la o temperatură de 1450 °C.
La convertoarele orizontale cu suflare laterală, mata de cupru este suflată cu aer comprimat pentru a avea loc oxidarea sulfurilor și a ferului. Apoi, oxizii rezultați sunt transformați în zgură, iar sulful în oxid. Convertorul produce cupru blister, care conține 98,4-99,4% cupru, fier, sulf, precum și cantități mici de nichel, staniu, argint și aur.
Cuprul blister este supus la foc și apoi la rafinare electrolitică. Impuritățile sunt îndepărtate cu gaze și transformate în zgură. Ca urmare a rafinării la foc, cuprul se formează cu o puritate de până la 99,5%. Și după rafinarea electrolitică, puritatea este de 99,95%.
2. Metoda hidrometalurgică implică levigarea cuprului cu o soluție slabă de acid sulfuric și apoi separarea metalului cuprului direct din soluție. Această metodă este utilizată pentru prelucrarea minereurilor de calitate scăzută și nu permite extracția asociată a metalelor prețioase împreună cu cuprul.

Aplicații de cupru
Datorită calităților lor valoroase, cuprul și aliajele de cupru sunt utilizate în industriile electrice și electrice, în radioelectronica și fabricarea de instrumente. Există aliaje de cupru cu metale precum zinc, staniu, aluminiu, nichel, titan, argint și aur. Mai puțin utilizate sunt aliajele cu nemetale: fosfor, sulf, oxigen. Există două grupe de aliaje de cupru: alama (aliaje cu zinc) și bronz (aliaje cu alte elemente).
Cuprul este foarte prietenos cu mediul, ceea ce permite utilizarea sa în construcția de clădiri rezidențiale. De exemplu, un acoperiș din cupru, datorită proprietăților sale anticorozive, poate rezista mai mult de o sută de ani fără îngrijire specială sau vopsire.
Cuprul din aliaje cu aur este folosit în bijuterii. Acest aliaj crește rezistența produsului, crește rezistența la deformare și abraziune.
Compușii cuprului se caracterizează printr-o activitate biologică ridicată. La plante, cuprul participă la sinteza clorofilei. Prin urmare, se poate observa în compoziția îngrășămintelor minerale. Lipsa de cupru în corpul uman poate cauza deteriorarea compoziției sângelui. Se găsește în multe produse alimentare. De exemplu, acest metal se găsește în lapte. Cu toate acestea, este important să ne amintim că excesul de compuși de cupru poate provoca otrăvire. Acesta este motivul pentru care nu ar trebui să gătiți alimente în vase de cupru. În timpul fierberii, cantități mari de cupru se pot scurge în alimente. Dacă vasele din interior sunt acoperite cu un strat de tablă, atunci nu există pericol de otrăvire.
În medicină, cuprul este folosit ca antiseptic și astringent. Este o componentă a picăturilor oftalmice pentru conjunctivită și a soluțiilor pentru arsuri.